C.3.5 Neuromusculaire elektrostimulatie
Behandel patiënten met stabiel COPD niet met neuromusculaire elektrostimulatie (NMES) wanneer ze in staat zijn om zelf fysieke training uit te voeren.
Overweeg (verwijzing voor) behandeling met NMES wanneer patiënten met stabiel COPD gedurende langere tijd niet in staat zijn om zelf fysieke training uit te voeren.
Deze benadering kan bijvoorbeeld worden toegepast bij patiënten met een hele hoge mate van kortademigheid bij aan- en uitkleden in combinatie met verzwakte beenspieren, bij patiënten met orthopedische klachten, bij bedlegerigheid en/of bij patiënten met een ernstige COPD-longaanval.
Overweeg bij patiënten die vanwege een COPD-longaanval zijn opgenomen in het ziekenhuis NMES-behandeling in combinatie met mobilisatieoefeningen.
Pas NMES-behandeling toe bij patiënten die aan de beademing liggen, langdurig bedlegerig zijn en/of bij ernstig verzwakte patiënten die moeilijk te mobiliseren zijn.
Indien behandeling met NMES is aangewezen, pas deze dan als volgt toe:
- stimuleer ten minste de mm. quadriceps femoris
- plaats bij voorkeur grote, rubberen elektroden zover mogelijk uit elkaar op de spierbuik
- gebruik een rechthoekpuls met een frequentie van minimaal 35 Hz en een pulsduur van minimaal 300 µs in een serietijd met een verhouding van 1:1 tot 1:2
- stel de intensiteit (pulsamplitude) zo hoog dat de contractie zichtbaar en/of voelbaar is, bij voorkeur tot maximale tolerantiegrens zonder pijn
- stimuleer ten minste 15 minuten per sessie gedurende minimaal vier weken, met een behandelfrequentie van drie keer per week
- combineer NMES waar mogelijk met actieve oefeningen
Uitgangsvraag
- Wanneer dient behandeling met neuromusculaire elektrostimulatie (NMES) plaats te vinden bij patiënten met COPD?
- Op welke wijze dient NMES toegepast te worden bij patiënten met COPD?
Aanleiding
Hoewel het positieve effect van oefentherapie voor patiënten met COPD algemeen bekend is, zijn niet alle patiënten met COPD tot reguliere fysieke training in staat vanwege bijvoorbeeld zeer ernstige kortademigheid of omdat ze bedlegerig zijn bij (invasieve) beademing. Mogelijk kan behandeling met neuromusculaire elektrostimulatie (NMES) het fysiek functioneren en de kwaliteit van leven van deze patiënten verbeteren.
1 Wanneer dient behandeling met neuromusculaire elektrostimulatie (NMES) plaats te vinden bij patiënten met COPD?
Literatuur
Bij patiënten met stabiel COPD heeft NMES in combinatie met oefentherapie nauwelijks toegevoegde waarde in vergelijking met oefentherapie zonder NMES (lage tot zeer lage bewijskracht).
Bij patiënten met stabiel COPD die niet fysieke trainen leidt behandeling met NMES tot zeer grote verbetering van het functioneel inspanningsvermogen en een kleine verbetering van de perifere spierkracht in vergelijking met gebruikelijke zorg (lage bewijskracht). Bij patiënten met COPD die vanwege een longaanval zijn opgenomen in het ziekenhuis leidt de combinatie van NMES en mobilisatieoefeningen tot zeer grote verbetering van het fysiek functioneren, het inspanningsvermogen en de perifere spierkracht en een grote vermindering van kortademigheid (laag tot zeer lage bewijskracht).
Er zijn geen aanwijzingen voor een verhoogd risico op mortaliteit (matige bewijskracht) of ongewenste voorvallen die gerelateerd zijn aan de behandeling met NMES (lage bewijskracht).
Overwegingen
Bij patiënten die opgenomen zijn in het ziekenhuis, zijn de effecten van NMES groot en waardevol. Ook bij patiënten met stabiel COPD die niet in staat zijn tot fysieke training kan NMES mogelijk van waarde zijn. De behandeling met NMES is niet pijnlijk en goed aanvaardbaar voor patiënten. De benodigde apparatuur is in de meeste revalidatiecentra en ziekenhuizen en in sommige eerstelijnspraktijken reeds aanwezig.
2 Op welke wijze dient NMES toegepast te worden bij patiënten met COPD?
Bij NMES worden bij voorkeur grote, rubberen elektroden in combinatie met sponsjes en klittenbanden gebruikt (Lieber 1991). De mm. quadriceps femoris wordt gestimuleerd, eventueel in combinatie met de hamstrings of de mm. gastrocnemii. De elektroden worden zover mogelijk uit elkaar op de spierbuik geplaatst, bij voorkeur op de motorische prikkelpunten. Een bifasische rechthoekpuls wordt gebruikt, met een frequentie van minimaal 35 Hz gedurende minimaal 300 µs in een serietijd met een verhouding van 1:1 tot 1:2. De intensiteit (pulseamplitude) moet minimaal leiden tot een zichtbare en/of voelbare contractie, bij voorkeur tot de maximale tolerantiegrens zonder pijn. De duur van de stimulatie is ten minste 15 minuten en wordt minimaal vier weken toegepast met een behandelfrequentie van drie keer per week (Herzig 2015; Maffiuletti 2018; Vivodtzez 2008).
Parameters voor optimale stimulatie
- golfvorm rechthoekpuls
- frequentie minimaal 35 Hz
- pulsduur minimaal 300 µs
- intensiteit maximale tolerantie of bij zichtbare en duidelijk voelbare contractie
- duur van de sessie: minimaal 15 min
- aantal trainingssessies: minimaal 12 sessies
- serietijd (op/af):
- op = minimaal 5 sec. op
- af = maximaal tweemaal zo lang als ‘op’
Om de eerste uitgangsvraag te kunnen beantwoorden, is er een systematische literatuuranalyse verricht naar de volgende reviewvragen (PICO):
- Wat zijn de effecten van behandeling met NMES (‘stand alone’) bij patiënten met stabiel COPD zonder oefentherapie?
- Wat zijn de effecten van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD in aanvulling op de oefentherapie?
- Wat zijn de effecten van behandeling met NMES bij patiënten die met een COPD-longaanval zijn opgenomen in het ziekenhuis (IC of HC)?
Uitkomstmaten
Kwaliteit van leven, fysiek functioneren (bijv. de tijd tot het behalen van specifieke mijlpalen op het gebied van mobiliteit), kortademigheid, (functioneel) inspanningsvermogen, perifere spierkracht, opnameduur (indien van toepassing), mortaliteit en ongewenst voorvallen zijn aangemerkt als patiëntrelevant en cruciaal voor de besluitvorming.
Zoeken en selecteren
Zoekactie
Door middel van een systematische zoekactie is op 7 juni 2018 met relevante zoektermen gezocht naar gerandomiseerde gecontroleerde studies (RCT’s) in onder meer de databases ‘PubMed’, ‘EMBASE’, ‘CENTRAL’, ‘Cochrane Library’, ‘Web of Science’, ‘PeDRO’, ‘Psychinfo’ en ‘EmCare’. De verantwoording van de zoekactie is opgenomen in bijlage C.3.5.
Literatuurselectie
De studies werden geselecteerd op grond van de volgende selectiecriteria: RCT, gepubliceerd in de Engelse of Nederlandse taal, naar de gewenste effecten (kwaliteit van leven, (functioneel) inspanningsvermogen) en/of ongewenste effecten (ongewenste voorvallen en mortaliteit) van NMES (NMES als op zichzelf staande interventie of in combinatie met oefentherapie (‘add-on’)) bij patiënten met COPD in vergelijking met gebruikelijke zorg (zonder oefentherapie) of alleen oefentherapie.
De recente literatuurstudie van Hill (2018) naar de effectiviteit van NMES bij mensen met COPD is als uitgangspunt gebruikt. De 16 RCT’s binnen deze review zijn allemaal getoetst aan de selectiecriteria van deze uitgangsvraag. Eén studie rapporteerde geen relevante uitkomstmaten (Giavedon 2012) en is zodoende niet geïncludeerd. De overige 15 studies zijn wel in de literatuuranalyse opgenomen.
De literatuurzoekactie leverde nog eens 115 treffers op. De artikelen die werden gepubliceerd vanaf maart 2018 zijn getoetst aan de selectiecriteria op basis van titel, abstract en volledige tekst. Bij deze update is één artikel (Bonnevie 2018) toegevoegd aan de review. Het totale aantal studies in deze literatuuranalyse komt daarmee op 16.
De artikelen die op basis van de volledige tekst zijn geëxcludeerd en de reden van exclusie zijn opgenomen in de bijlage.
Samenvatting literatuur
Beschrijving studies
De literatuuranalyse van de 16 studies betrof in totaal 329 patiënten met COPD. De gemiddelde leeftijd van de patiënten varieerde tussen de 56 en 76 jaar. De effectiviteit van NMES is onderzocht bij zowel patiënten met een stabiel ziektebeeld (13 studies) als bij patiënten die vanwege een longaanval zijn opgenomen in het ziekenhuis (3 studies).
In 13 van de 16 studies was sprake van een stabiel ziektebeeld bij de patiënten met COPD. NMES werd in deze studies in verschillende settings toegepast: in de thuissituatie (Akinlabi 2013; Bonnevie 2018; Latimer 2013; Maddocks 2016; Tardif 2015; Vieira 2014; Vivodtzev 2012), zowel poliklinisch als thuis (Neder 2002), poliklinisch (Bourjeily-Habr 2002; Dang 2011; Tasdemir 2015), of binnen intramurale revalidatie (Kucio 2016; Vivodtzev 2006). Zes van de 13 studies onderzochten de effectiviteit van NMES als ‘stand alone’-interventie in vergelijking met gebruikelijke medische zorg (Bourjeily-Habr 2002; Latimer 2013; Maddocks 2016; Neder 2002; Vieira 2014; Vivodtzev 2012). In de overige zeven studies werd de effectiviteit van NMES als een toevoeging (‘add-on’) aan oefentherapie onderzocht en vergeleken met oefentherapie zonder NMES (Akinlabi 2013; Dang 2011; Kucio 2016; Tardif 2015; Tasdemir 2015; Vivodtzev 2006; Bonnevie 2018). De toepassing van NMES als ‘stand alone’-interventie en als ‘add-on’-interventie in combinatie met oefentherapie zijn apart geanalyseerd.
Drie van de 16 studies onderzochten de effectiviteit van NMES bij patiënten met COPD die vanwege een longaanval waren opgenomen op de intensive care (IC; Abdellaoui 2011; Akar 2017) of na IC-opname waren opgenomen op de high care (HC; Zanotti 2003). In twee studies werden de patiënten invasief beademd (Akar 2017; Zanotti 2003). De studie van Abdellaoui (2011) betrof patiënten die zowel zuurstofsuppletie, niet-invasieve ventilatie als invasieve ventilatie ontvingen. In de studies van Akar (2017) en Zanotti (2003) werd mobilisatie met NMES vergeleken met actieve mobilisatie zonder NMES. In de studie van Abdellaoui (2011) werd actieve- passieve mobilisatie met NMES vergeleken met actieve-passieve mobilisatie met placebo-NMES onder veelal bedlegerige patiënten met ernstig verzwakte spierfunctie, ernstige functionele beperkingen en een lange periode van immobiliteit. Gezien de kwetsbare gezondheid, verslechterde conditie, duidelijke spieratrofie en langdurige bedlegerigheid van deze patiënten werden de resultaten van deze drie studies apart geanalyseerd. In één studie ontvingen alle deelnemers unilaterale NMES en diende het andere been (zonder NMES) als controlebeen (Latimer 2013). Deze studie randomiseerde dan ook per been in plaats van per deelnemer. In de overige studies werden de deelnemers gerandomiseerd en ontvingen deze in de interventiegroep bilaterale NMES. Alle studies stimuleerden de mm. quadriceps femoris, soms in combinatie met de hamstrings (Abdellaoui 2011; Akinlabi 2013), de kuitspieren (Kucio 2016), de hamstrings én de kuitspieren (Bourjeily-Habr 2002; Vivodtzev 2012) of de mm. gluteii (Zanotti 2003). De stimulatiefrequenties waren 35 Hz (Abdellaoui 2011; Bonnevie 2018; Kucio 2016; Tardif 2015; Vivodtzev 2006; Zanotti 2003), 45 Hz (Dang 2011) en 50 Hz (Akar 2017; Akinlabi 2013; Bourjeily-Habr 2002; Latimer 2013; Maddocks 2016; Neder 2002; Tasdemir 2015; Vieira 2014; Vivodtzev 2012). De pulseduur varieerde tussen de 200 µs (Bourjeily-Habr 2002) en 400 µs (Abdellaoui 2011; Bonnevie 2018; Vivodtzev 2006, 2012).
Er waren 11 studies die informatie rapporteerden over de serietijd; deze informatie werd niet beschreven in de studies van Abdellaoui (2011), Akinlabi (2013), Tardif (2015) en Zanotti (2003). In drie studies (Maddocks 2016; Neder 2002; Vieira 2014) was er geen vaste serietijd, maar liep de serietijd op gedurende de studieperiode: van 2 sec stimulatie en 15 of 18 sec rust in de eerste week, naar 10 sec stimulatie en 15 sec of 30 sec rust in de derde week. In de overige studies was er de gehele studieperiode eenzelfde serietijd. Deze serietijd varieerde van heel korte cycli zoals 0,5 sec stimulatie en 1,5 sec rust in de studie van Bonnevie (2018) en 2 sec stimulatie en 4 sec rust in de studie van Kucio (2016) tot langere cycli zoals 10 sec stimulatie en 20 sec rust in de studie van Tasdemir (2015) en 15 sec stimulatie en 5 sec rust in de studie van Latimer (2013).
De intensiteit van de stimulatie was in de meeste studies ingesteld op de maximale stroom die de patiënt aanvaardbaar vond. In één studie was de intensiteit voldoende voor het opwekken van een spiercontractie en die intensiteit nam met 5 mA per week toe (Bourjeily-Habr 2002); in een andere studie was de ingestelde intensiteit gelijk aan een spiercontractie die overeenkomt met 15 tot 25% van de maximale vrijwillige contractie (Maddocks 2016).
De meeste studies stimuleerden de spieren een- of tweemaal per dag gedurende 30 tot 60 minuten, drie tot zeven dagen per week gedurende vier tot acht weken.
Een gedetailleerd overzicht van de geïncludeerde studies is online beschikbaar als ‘Bijlage Evidencetabellen’.
Individuele studiekwaliteit
De opzet en uitvoering van de individuele studies (‘risk of bias’; RoB) is beoordeeld met behulp van de ‘Cochrane Risk-of-Biastool’. Het ontbreken van blindering van patiënten en zorgpersoneel was hierbij de meest voorkomende potentiële oorzaak van vertekening. Een overzicht van de beoordeling van de studiekwaliteit (RoB) per studie is weergegeven in de volgende tabel.
Risk of bias: NMES

Resultaten en bewijskracht
Hierna worden de resultaten en de bewijskracht beschreven van:
- NMES zonder oefentherapie (‘stand alone’) bij patiënten met stabiel COPD in vergelijking met gebruikelijke zorg [link]
- NMES in combinatie met oefentherapie (‘add on’) in vergelijking met enkel oefentherapie bij patiënten met stabiel COPD [link]
- NMES in combinatie met mobilisatie bij patiënten die met een COPD-longaanval zijn opgenomen in het ziekenhuis (IC of HC) [link]
NMES zonder oefentherapie (‘stand alone’) bij patiënten met stabiel COPD in vergelijking met gebruikelijke zorg
Kwaliteit van leven
Het effect van NMES op de kwaliteit van leven vergeleken met gebruikelijke zorg is gerapporteerd in twee studies (Maddocks 2016; Vieira 2014). Beide studies hebben de ‘St. George’s Respiratory Questionnaire’ (SGRQ) gebruikt. De studies vonden een kleine, klinisch-relevante verbetering van de kwaliteit van leven; de SGRQ-score van patiënten met NMES-behandeling was gemiddeld 4,12 punten lager dan van patiënten die gebruikelijke zorg ontvingen (95%-BI = -12,60 tot 4,35; n = 72). Een verschil van 4 punten wordt internationaal gezien als klinisch-relevant (Jones 2005). Zie de forestplot.
De bewijskracht voor de kwaliteit van leven is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘stand alone’) bij patiënten met stabiel COPD: kwaliteit van leven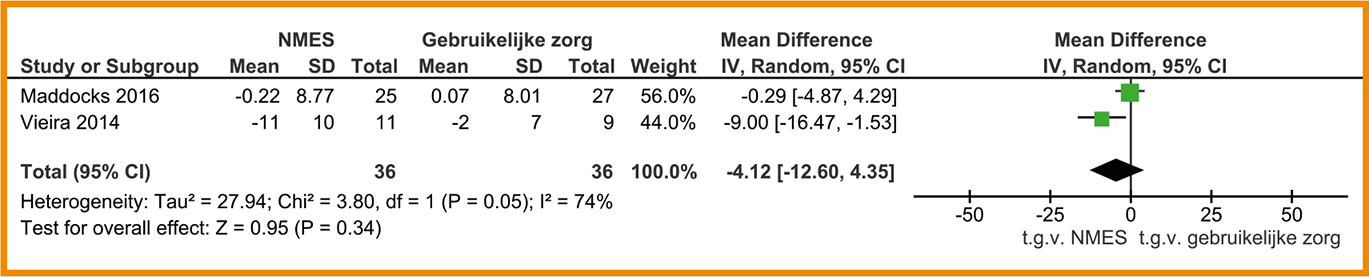
Fysiek functioneren
Effecten van NMES op fysiek functioneren is in geen van de geïncludeerde studies onderzocht.
Kortademigheid
Behandeling met NMES leidt tot een grote vermindering van kortademigheid (Neder 2002; Vieira 2014; Vivodtzev 2012). De effecten van NMES op kortademigheid na afloop van een symptoomgelimiteerde inspanningstest is in alle drie de studies onderzocht met de Borgschaal. Patiënten die waren behandeld met NMES scoorden op de Borgschaal gemiddeld 1,0 punt lager (95%-BI = -2,13 tot 0,06) dan patiënten in de controlegroep.
De studie van Neder (2002) laat tevens een grote, klinisch-relevante vermindering zien van kortademigheid in het dagelijks leven, die in deze studie is gemeten met het domein ‘Dyspneu’ van de ‘Chronic Respiratory Disease Questionnaire’ (CRDQ). Na zes weken behandeling was er gemiddeld 1,2 punten (95%-BI = 0,4 tot 2,0) verschil tussen de groep met NMES en de controlegroep die gebruikelijke zorg kreeg. Een verschil van 0,5 punten per domein wordt gezien als een klinisch-relevante verandering in gezondheidsstatus (Gyatt 1987). Zie de forestplot.
De bewijskracht voor het effect van NMES op kortademigheid is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering, de inconsistentie van de resultaten en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Forestplot van behandeling met NMES (‘stand alone’) bij patiënten met stabiel COPD: kortademigheid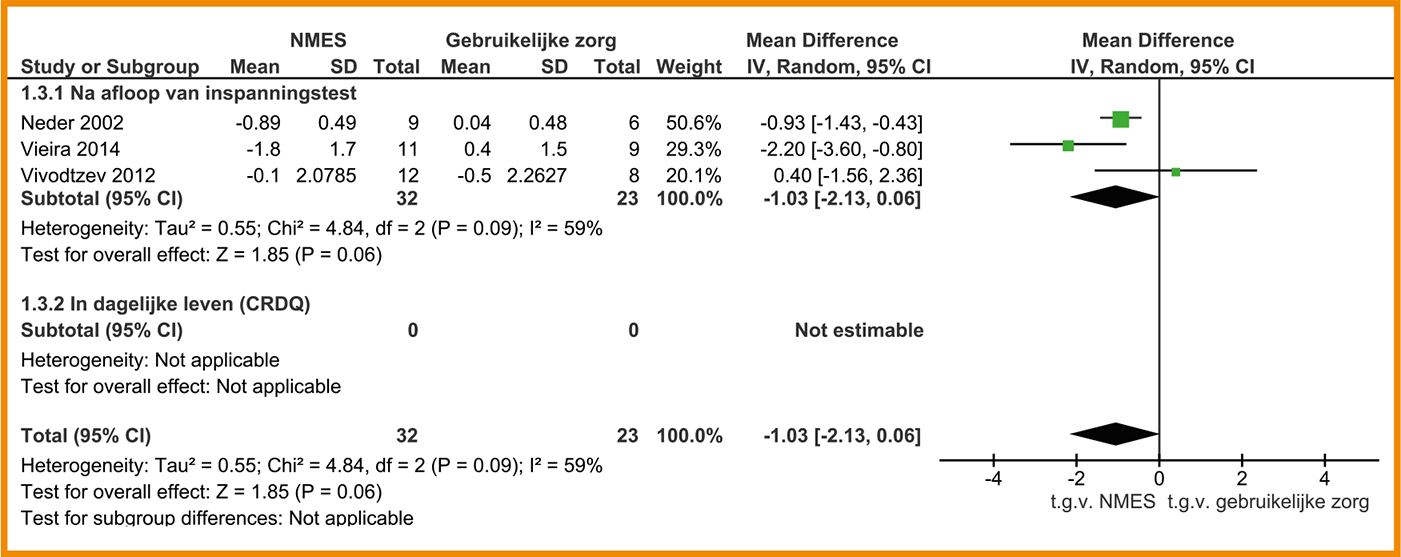 Functioneel inspanningsvermogen
Functioneel inspanningsvermogen
Vijf van de zes studies naar het effect van NMES op het functioneel inspanningsvermogen rapporteren voldoende data voor een meta-analyse. Deze meta-analyse toont een grote tot zeer grote verbetering van het inspanningsvermogen (SMD = 1,20; 95%-BI = 0,64 tot 1,75; n = 127).
Twee van de studies (Maddocks 2016; Vieira 2014) tonen een grote, klinisch-relevante verbetering op de Zes Minuten Wandeltest (6MWT). Patiënten die waren behandeld met NMES liepen gemiddeld 39,3 m verder dan patiënten die geen NMES-behandeling hadden kregen (95%-BI = 16,3 tot 62,2; n = 72). Een verschil van 30 m wordt internationaal gezien als klinisch-relevant (Holland 2015).
Het effect van NMES op het functioneel inspanningsvermogen is in drie studies gemeten met duurtests; de Constant-vermogen-fietstest en de ‘Endurance shuttle walk test’ (ESWT). Patiënten die NMES-behandeling kregen, toonden een zeer grote verbetering op deze tests; zij hielden het gemiddeld 3,62 minuten langer vol (95%-BI = 2,33 tot 4,91; n = 55). Ook Bourjeily-Habr (2002) tonen een significant effect van NMES aan op de fysieke capaciteit, die hier is gemeten met de ‘Incremental Shuttle Walk Test’ (ISWT; n = 18; effectgrootte onbekend: geen data beschikbaar). Zie de forestplot.
De bewijskracht voor functioneel inspanningsvermogen is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘stand alone’) bij patiënten met stabiel COPD: functioneel inspanningsvermogen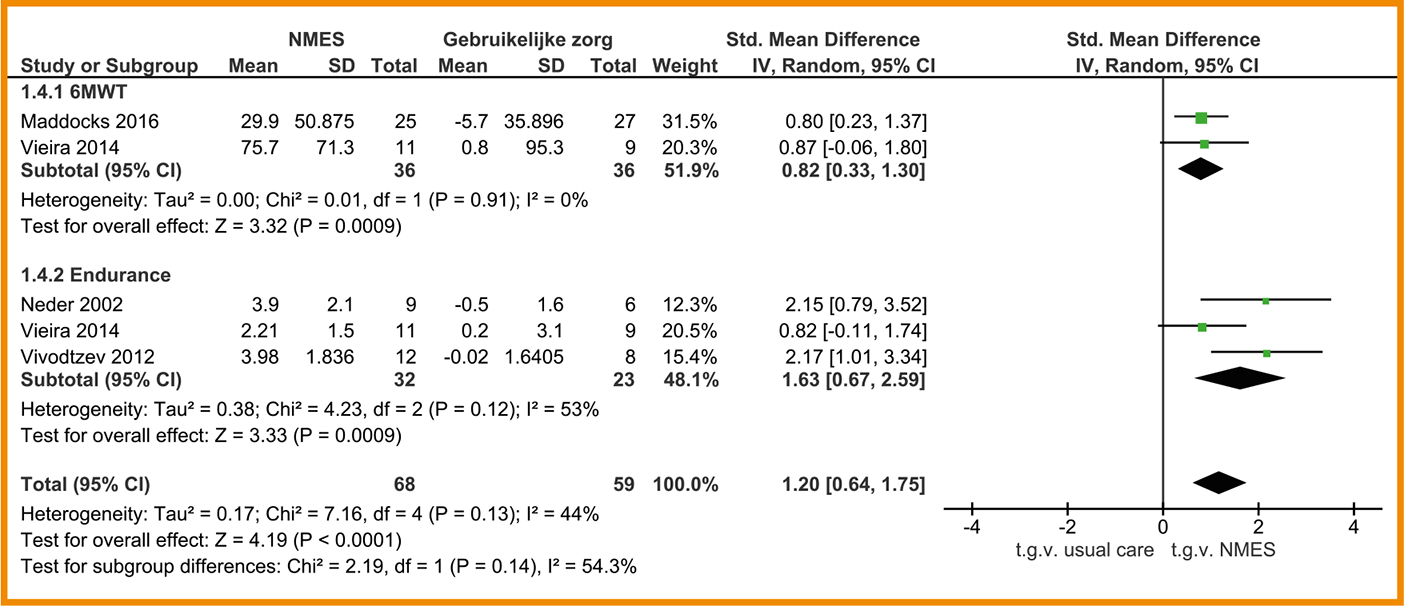
Perifere spierkracht
Vijf studies vinden een kleine toename van kracht van de m. quadriceps na NMES-behandeling (SMD = 0,34; 95%-BI = 0,00 tot 0,68; n = 137). Bourjeily-Habr (2002) toont tevens een toename in kracht van de hamstrings. Zie de forestplot.
De bewijskracht voor het effect op perifere spierkracht is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot behandeling met NMES (‘stand alone’) bij patiënten met stabiel COPD: perifere spierkracht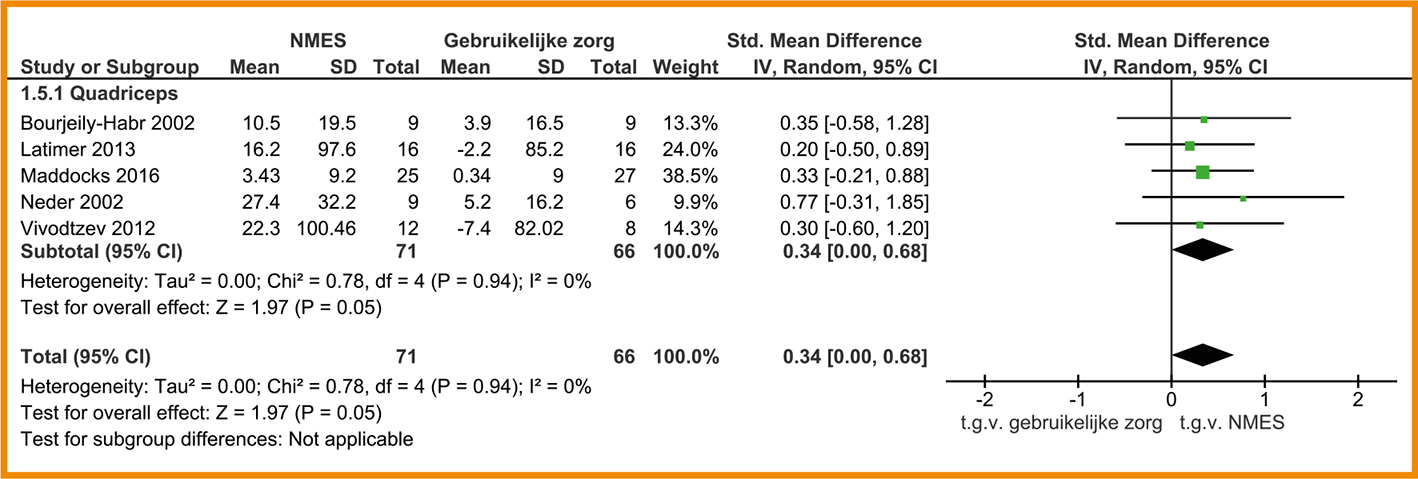
Mortaliteit
Mortaliteit is in 12 studies gerapporteerd. In deze studies is geen risicoverschil (RV) gevonden tussen NMES en gebruikelijke zorg (5 studies; n = 131; RV = -0,02; 95%-BI = -0,08 tot 0,05).
De bewijskracht voor het ernstig ongewenste voorval mortaliteit is met één niveau verlaagd gezien het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op matig.
Ongewenste voorvallen
Uit de vijf studies naar ongewenste voorvallen die zijn gerelateerd aan NMES komt geen verhoogd risico naar voren in vergelijking met gebruikelijke zorg (RV = 0%; 95%-BI = -0,07 tot 0,07; n = 139).
De bewijskracht voor ongewenste voorvallen die zijn gerelateerd aan de interventie is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Een overzicht van de effecten en de bewijskracht op alle uitkomsten is weergegeven in de volgende tabel.
GRADE-evidenceprofiel van behandeling met NMES zonder oefentherapie (‘stand alone’) in vergelijking met gebruikelijke zorg bij patiënten met stabiel COPD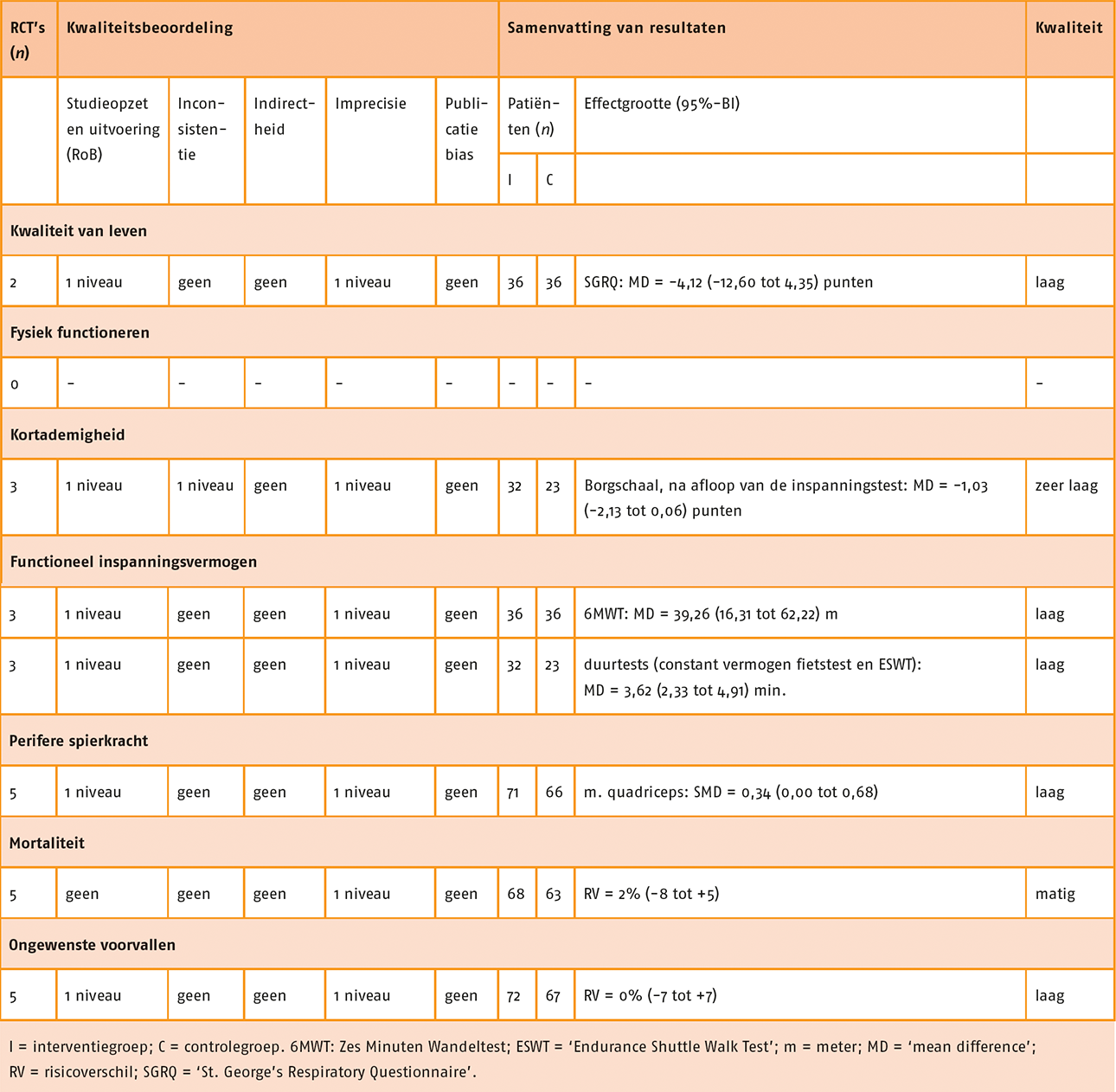
NMES in combinatie met oefentherapie (‘add on’) in vergelijking met enkel oefentherapie bij patiënten met stabiel COPD
Kwaliteit van leven
Het effect van NMES in combinatie met oefentherapie op de kwaliteit van leven is gerapporteerd in vijf studies (Akinlabi 2013; Bonnevie 2018; Dang 2011; Tardif 2015; Vivodtzev 2006). In de studies is de SGRQ (3 studies), gebruikt, de ‘Chronic Respiratory Disease Questionnaire’ (CRDQ) en de ‘Maugeri Respiratory Failure’ (MRF-28). De meta-analyse laat een matig tot groot effect (SMD = -0,55; 95%-BI = -0,96 tot -0,13; n = 146) zien ten gunste van NMES met oefentherapie ten opzichte van enkel oefentherapie. Zie de forestplot.
De bewijskracht voor de kwaliteit van leven is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD: Kwaliteit van leven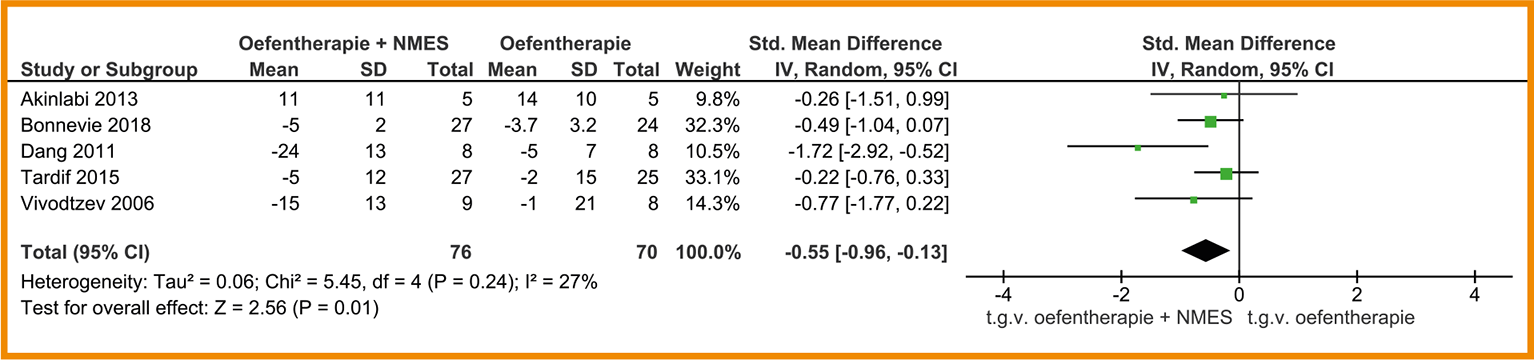 Fysiek functioneren
Fysiek functioneren
Effecten van NMES op fysiek functioneren is in geen van de geïncludeerde studies onderzocht.
Kortademigheid
De mate van kortademigheid in het dagelijks leven is in twee studies onderzocht (Dang 2011; Vivodtzev 2006). Echter, beide studies rapporteren onvoldoende data voor een meta-analyse. In de studie van Dang (2011) was het onduidelijk of er verschil was tussen de verbetering van de interventie- en die van de controlegroep. Het verschil in de studie van Vivodtzev (2006) was op de grens van significantie (p = 0,05).
De effecten van NMES op kortademigheid direct na afloop van een symptoomgelimiteerde inspanningstest zijn in drie studies onderzocht met behulp van de Borgschaal (Bonnevie 2018; Tasdemir 2015; Vivodtzev 2006). Patiënten in de NMES-groep scoorden 0,22 punten lager op deze schaal dan patiënten in de controlegroep (95%-BI = -0,83 tot 0,40; n = 95); een klein effect. Zie de forestplot.
De bewijskracht voor (functioneel) inspanningsvermogen is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD: kortademigheid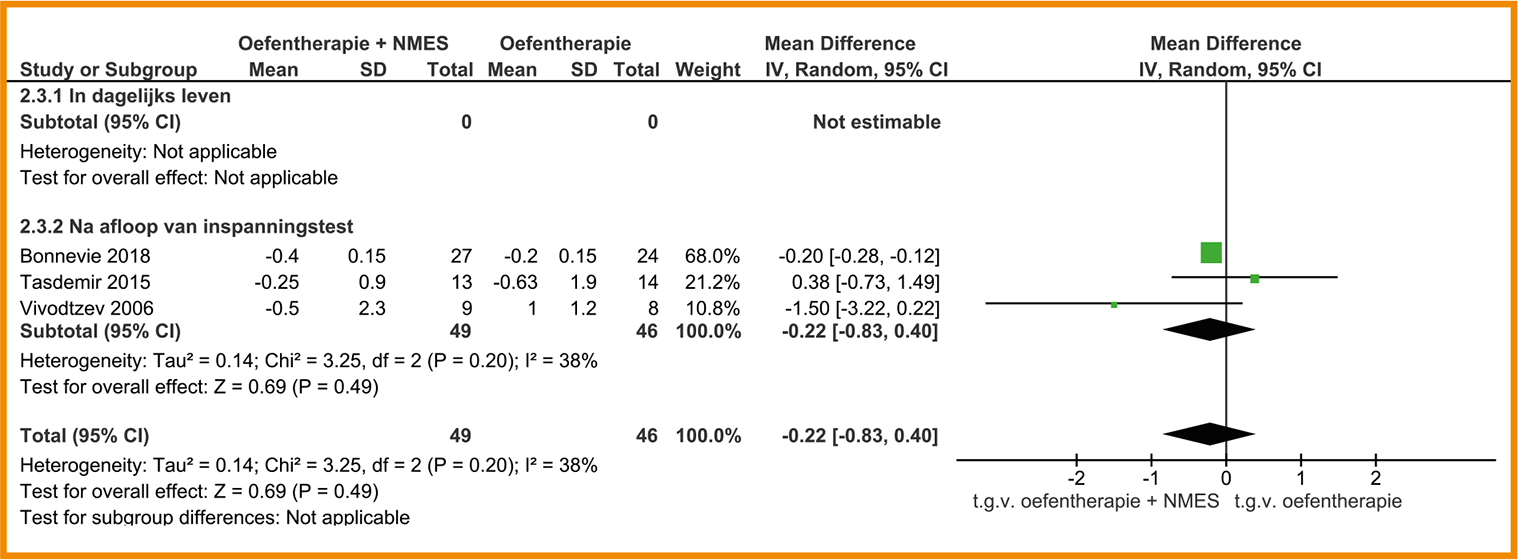
Functioneel inspanningsvermogen
In combinatie met oefentherapie heeft NMES geen effect (zelfs een zeer klein negatief effect) op het functioneel inspanningsvermogen vergeleken met reguliere oefentherapie zonder NMES. In zes studies liepen patiënten die oefentherapie plus NMES ontvingen gemiddeld drie meter minder dan patiënten die oefentherapie zonder NMES ontvingen (95%-BI = -7,6 tot 1,4; n = 174). De ISWT toonde ook geen significante effecten aan van oefentherapie plus NMES op het inspanningsvermogen, maar de ESWT wel (Tasdemir 2015; onvoldoende data gerapporteerd voor de berekening van de effectgrootte en/of opname in meta-analyse). Zie de forestplot.
De bewijskracht voor het functioneel inspanningsvermogen is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD: functioneel inspanningsvermogen Perifere spierkracht
Perifere spierkracht
Drie studies (Dang 2011; Tasdemir 2015; Vivodtzev 2006) rapporteerden een kleine toename in spierkracht van de m. quadriceps (SMD = 0,20; 95%-BI = -0,32 tot 0,71; n = 60). Zie de forestplot.
De bewijskracht voor het effect op de perifere spierkracht is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het gering aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD: perifere spierkracht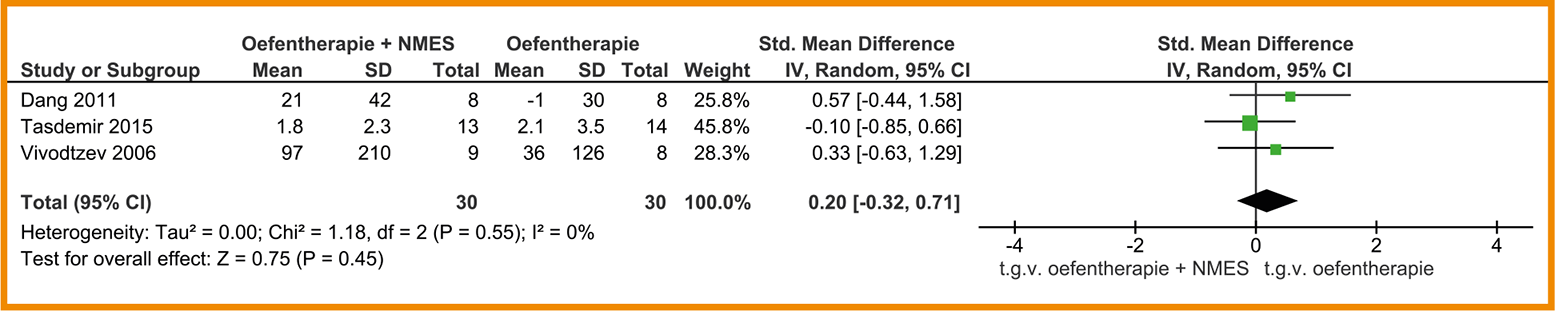
Mortaliteit
Tussen oefentherapie met en zonder NMES is mogelijk geen risicoverschil in mortaliteit. In geen van de vijf studies die data over mortaliteit rapporteren is een patiënt overleden (RV = 0,00; 95%-BI = -0,06 tot 0,06;
n = 142). Zie de forestplot.
De bewijskracht voor de uitkomstmaat mortaliteit is met één niveau verlaagd gezien het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op matig.
Forestplot van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD: mortaliteit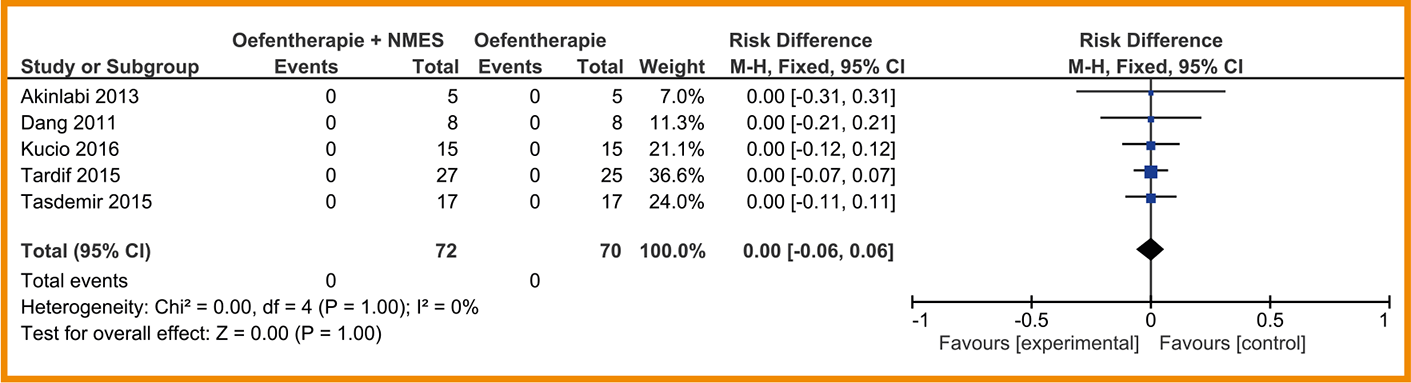
Ongewenste voorvallen
NMES geeft mogelijk geen verhoging van het risico op ongewenste voorvallen bij oefentherapie met NMES ten opzichte van oefentherapie zonder NMES (zes studies; n = 144; RV = 0,0; 95%-BI = -0,05 tot 0,05).
De bewijskracht voor ongewenste voorvallen gerelateerd aan de interventie is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (o.a. blindering) en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Een overzicht van de effecten en de bewijskracht op alle uitkomsten is weergegeven in de volgende tabel.
GRADE-evidenceprofiel van de resultaten van NMES in combinatie met de oefentherapie (‘add on’) in vergelijking met enkel oefentherapie bij patiënten met stabiel COPD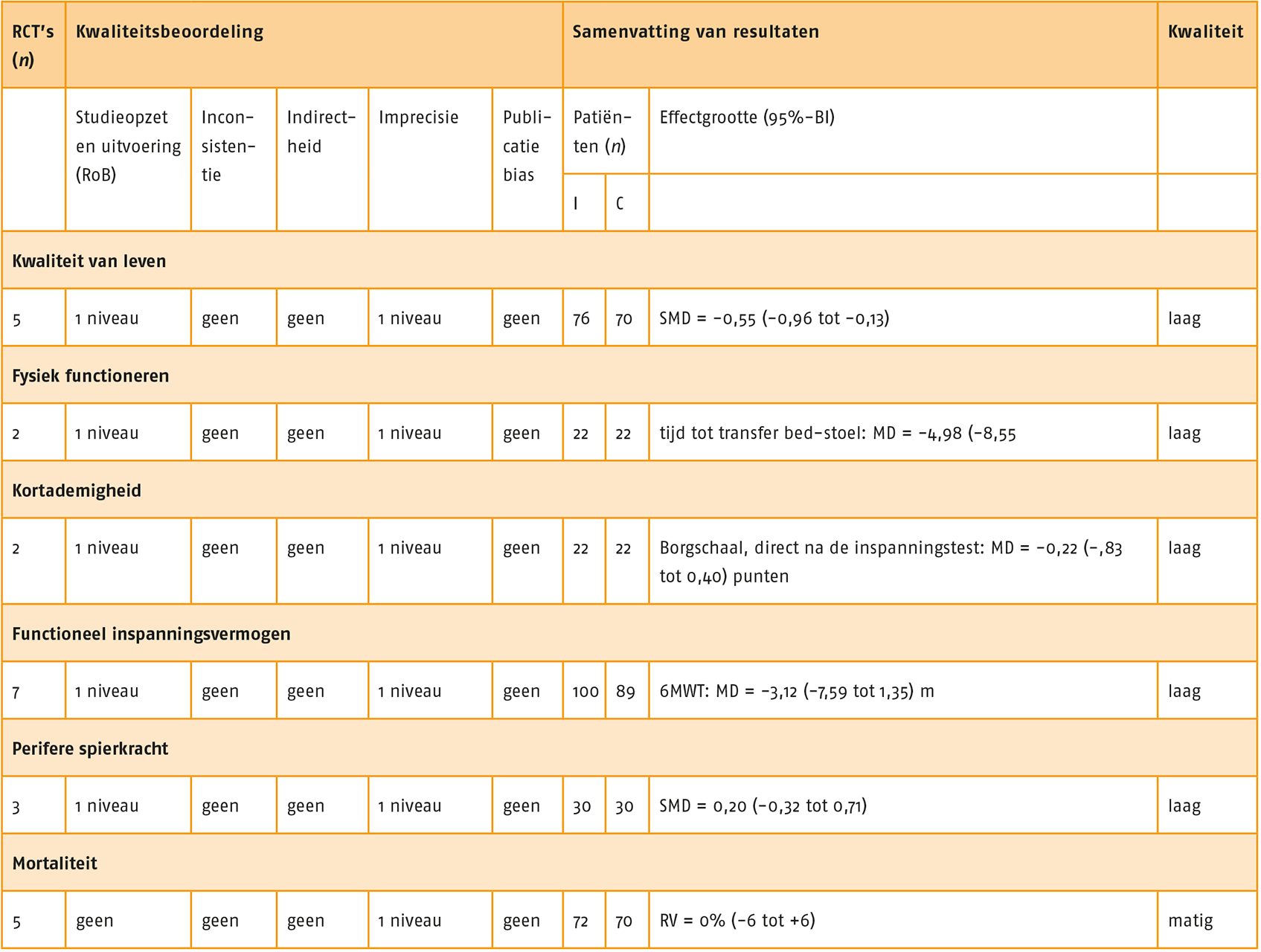
Overwegingen
De overwegingen en aanbevelingen komen voort uit de discussies die in de werkgroep zijn gevoerd aan de hand van evidence-to-decisionformulieren. Zie bijlage C.3.5.
De overwegingen betroffen:
Gewenste effecten Bij patiënten met stabiel COPD die in staat zijn tot fysieke training lijkt toepassing van NMES in combinatie met fysieke training (‘add-on’) nauwelijks van toegevoegde waarde vergeleken met oefentherapie zonder NMES. Gezien deze resultaten lijkt behandeling met NMES geen waarde toe te voegen aan fysieke training bij patiënten met stabiel COPD en lijkt behandeling met NMES bij deze patiënten niet zinvol. Wanneer patiënten met stabiel COPD geen fysieke training ontvangen, geeft toepassing van NMES mogelijk wel verbetering van bijvoorbeeld het inspanningsvermogen en de perifere spierkracht vergeleken met gebruikelijke zorg. Men kan hierbij denken aan patiënten die niet in staat zijn tot fysieke training, bijvoorbeeld omdat zij bedlegerig zijn en/of een ernstige longaanval doormaken. Het is ook mogelijk dat patiënten niet in staat zijn tot fysieke training vanwege orthopedische klachten. Hoewel er geen studies bekend zijn naar de effecten van NMES bij patiënten met COPD én orthopedische klachten zijn er wel literatuurstudies waaruit positieve effecten blijken van NMES bij deze patiëntengroep, maar dan zónder COPD (Gatewood 2017; Herzig 2015). Bij patiënten met COPD die vanwege een longaanval zijn opgenomen in het ziekenhuis geeft NMES in combinatie met mobilisatie-oefeningen grote tot zeer grote verbeteringen van het fysiek functioneren, kortademigheid, inspanningsvermogen en de perifere spierkracht.
Ongewenste effecten Behandeling met NMES lijkt veilig; er zijn geen situaties gevonden die leiden tot een verhoogd risico op mortaliteit of ongewenste voorvallen die zijn gerelateerd aan de interventie.
Balans tussen gewenste en ongewenste effecten De gewenste effecten van NMES bij patiënten met COPD overtreffen waarschijnlijk de ongewenste effecten. NMES leidt immers tot gewenste effecten bij patiënten die vanwege een longaanval zijn opgenomen in het ziekenhuis en bij patiënten met stabiel COPD zonder fysieke training (‘stand alone’). Bovendien is er geen verhoogd risico op ongewenste effecten. Bij patiënten met stabiel COPD die in staat zijn tot fysieke training lijken er nauwelijks gewenste effecten te zijn van NMES; zodoende weegt voor NMES voor die groep niet op tegen mogelijke ongewenste effecten.
Waarde van de gewenste effecten Voor patiënten die vanwege een longaanval zijn opgenomen in het ziekenhuis is NMES van grote waarde voor het fysiek functioneren (transfer van bed naar stoel), de kortademigheid en het inspanningsvermogen. Ook wanneer patiënten met stabiel COPD geen fysieke training kunnen uitvoeren, kan NMES een positief effect hebben op deconditionering.
Variatie in de waarde van de gewenste effecten Welke waarde patiënten aan NMES toekennen, zal sterk uiteenlopen. De effecten van NMES zijn van grote waarde voor ziekenhuispatiënten, maar voor patiënten die in staat zijn om zelf hun uithoudingsvermogen te trainen, is de waarde van NMES zeer gering.
Benodigde middelen (kosten) De kosten van NMES voor de therapeut bestaan uit de aanschaf van de NMES-apparatuur; deze kosten bedragen circa 600 euro voor een vierkanaals spierstimulatieapparaat. Voor patiënten zijn er geen extra kosten verbonden aan behandeling met NMES wanneer zij zijn opgenomen in het ziekenhuis of in een revalidatiecentrum (de behandeling is inbegrepen en wordt vergoed uit de basisverzekering). Voor patiënten zonder indicatie voor ziekenhuisbehandeling of longrevalidatie vallen de kosten van NMES-behandeling onder de reguliere behandeling van de therapeut.
Variatie in benodigde middelen (kosten) De variatie in benodigde middelen is hoog. In ziekenhuizen en longrevalidatiecentra is de apparatuur meestal aanwezig. Echter, de apparatuur is geen onderdeel van de standaarduitrusting van eerstelijnspraktijken en is hier dus niet altijd aanwezig. Is behandeling met NMES aangewezen en de praktijk bezit niet over de juiste apparatuur, dan wordt de patiënt verwezen naar een praktijk die wel NMES-behandeling kan toepassen.
Kosteneffectiviteit Studies naar kosteneffectiviteit zijn niet gevonden. De kosteneffectiviteit van NMES wordt gunstig ingeschat. Gezien de positieve effecten op het fysiek functioneren kan NMES bij ziekenhuispatiënten mogelijk de opnameduur verkorten. Ook in de eerstelijnspraktijk lijkt kosteneffectiviteit van behandeling met NMES gunstig. Bij de behandeling van een longaanval en het tegengaan van verdere deconditionering kan ziekenhuisopname mogelijk worden voorkomen.
Aanvaardbaarheid Patiënten voelen wel de spiercontractie, maar ervaren geen pijn van neuromusculaire elektrostimulatie.
Haalbaarheid De implementatie van NMES in de dagelijkse praktijk is waarschijnlijk haalbaar. In ziekenhuizen en revalidatiecentra is het NMES-apparaat meestal beschikbaar. Houd rekening met beschikbaarheid van het NMES-apparaat bij behandeling in een eerstelijnspraktijk en verwijs de patiënt naar een praktijk die in bezit is van een NMES-apparaat.
NMES in combinatie met mobilisatie bij patiënten die met een COPD-longaanval zijn opgenomen in het ziekenhuis (IC of HC)
Kwaliteit van leven
Het effect van NMES op de kwaliteit van leven is niet gerapporteerd.
Fysiek functioneren
Twee studies onder IC-patiënten onderzochten de tijd tot zitten buiten bed (Akar 2017; Zanotti 2003). Deze studies tonen een zeer groot effect van NMES in combinatie met mobilisatie op het fysiek functioneren; patiënten in de interventiegroep konden gemiddeld vijf dagen eerder buiten bed zitten (95%-BI = -8,6 tot -1,4; n = 44). Zie de forestplot.
De bewijskracht voor fysiek functioneren is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES bij patiënten die met een COPD-longaanval zijn opgenomen in het ziekenhuis (IC of HC): fysiek functioneren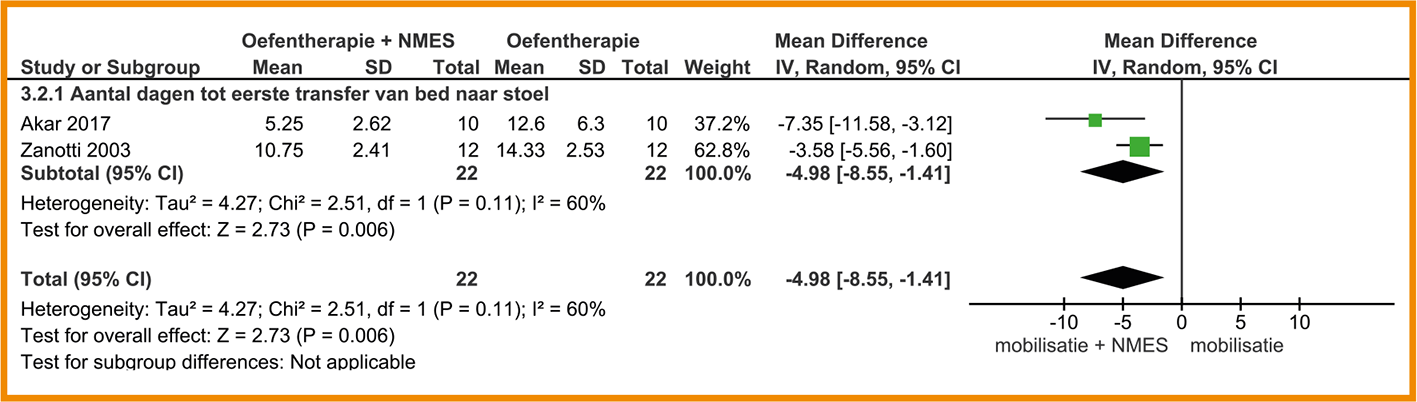
Kortademigheid
Symptomen van kortademigheid zoals gemeten met de ‘Medical Research Council Dyspnoe’ vragenlijst (MRC) zijn na behandeling met NMES één punt meer afgenomen dan na placebobehandeling (Abdellaoui 2011). De bewijskracht voor kortademigheid is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (1 niveau) en het geringe aantal patiënten (imprecisie; 2 niveaus). De bewijskracht komt hiermee uit op zeer laag.
Functioneel inspanningsvermogen
NMES geeft mogelijk een zeer grote, klinisch-relevante verbetering van het functioneel inspanningsvermogen. In de studie van Abdellaoui (2011) liepen patiënten die mobilisatie met NMES ontvingen gemiddeld 164,0 (± 68,2) meter en patiënten die mobilisatie met placebo-NMES ontvingen gemiddeld 72 (± 68,5) meter. Met 92,0 meter was het verschil in loopafstand zeer groot (95%-BI = 21,36 tot 162,64; n = 15). De bewijskracht voor kortademigheid is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (1 niveau) en het geringe aantal patiënten (imprecisie; 2 niveaus). De bewijskracht komt hiermee uit op zeer laag.
Perifere spierkracht
Zanotti (2003) toont een zeer groot effect aan van NMES op de spierkracht. Gemeten met een MRC-schaal van 0 (geen zichtbare of voelbare contractie) tot 5 (normale kracht) leidde mobilisatie met NMES tot een grotere verbetering van de spierkrachtscore (gemiddelde score= 2,16 ±1,02) dan mobilisatie zonder NMES (score = 1,25±0,75; SMD = 1,20; 95%-BI = 0,32 tot 2,08).
Ook Abdelloui (2011) toont een grotere toename in spierkracht aan van de m. quadriceps na mobilisatie met NMES (mediaan MVC = 10; IQR = 4,7-11,5 kg) dan na mobilisatie met placebo-NMES (mediaan MVC = 3; IQR = 1-5 kg; p = 0,02).
De bewijskracht voor kortademigheid is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (1 niveau) en het geringe aantal patiënten (imprecisie; 1 niveau). De bewijskracht komt hiermee uit op laag.
Opnameduur
Eén studie rapporteert informatie over de opnameduur. Deze studie van Akar (2017) toont 30% (95%-BI = -0,10 tot 0,70) grotere kans op ontslag van de IC-afdeling binnen vier weken na behandeling met mobilisatie plus NMES (8 van de 10 patiënten werden binnen 4 weken ontslagen van de IC) in vergelijking met patiënten die alleen mobilisatie ontvingen (5 van de 10 patiënten). Zie de forestplot.
De bewijskracht voor opnameduur is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (1 niveau) en het zeer geringe aantal patiënten (imprecisie; 2 niveaus). De bewijskracht komt hiermee uit op zeer laag.
Forestplot van behandeling met NMES bij patiënten die met een COPD-longaanval zijn opgenomen in het ziekenhuis (IC of HC): opnameduur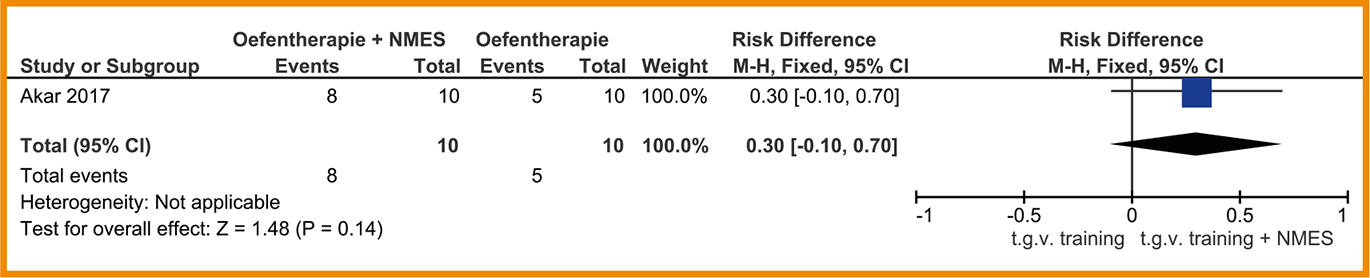 Mortaliteit
Mortaliteit
Behandeling met NMES geeft mogelijk geen verhoogd risico op overlijden (Zanotti 2003; Abdellaoui 2011).
De bewijskracht voor kortademigheid is met één niveau verlaagd gezien het geringe aantal patiënten (imprecisie) en komt hiermee uit op matig.
Ongewenste voorvallen
NMES geeft mogelijk geen verhoogd risico op ongewenste voorvallen (Abdellaoui 2011).
De bewijskracht voor ongewenste voorvallen is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (1 niveau) en het geringe aantal patiënten (imprecisie; 2 niveaus). De bewijskracht komt hiermee uit op zeer laag.
Een overzicht van de effecten en de bewijskracht op alle uitkomsten is weergegeven in de volgende tabel.
GRADE-evidenceprofiel NMES in combinatie met mobilisatie (‘add-on’) in vergelijking met enkel mobilisatie bij patiënten met COPD die zijn opgenomen op de IC- of de HC-afdeling van het ziekenhuis
Literatuur over de toepassing van NMES
Voor het beantwoorden van de uitgangsvraag* over de wijze van toepassing van NMES is in overleg met de werkgroep en de klankbordgroep om pragmatische redenen besloten geen systematisch literatuuronderzoek uit te voeren. De literatuur over dit onderwerp is op niet-systematische wijze vergaard en staat in onderstaande literatuurlijst vermeld.
- Abdellaoui A, Prefaut C, Gouzi F, Couillard A, Coisy-Quivy M, Hugon G, et al. Skeletal muscle effects of electrostimulation after COPD exacerbation: a pilot study. European Respiratory Journal 2011;38(4):781-8.
- Akar O, Gunay E, Ulasli SS, Ulasli AM, Kacar E, Sariaydin M, et al. Efficacy of neuromuscular electrical stimulation in patients with COPD followed in intensive care unit. Clin Resp J. 2017;11(6):743-50.
- Akinlabi K, Main E, Garrod R, Harvey A. Neuromuscular electrical stimulation (NMES), a new strategy in the pulmonary rehabilitation of patients with severe and very severe MRC 4 and 5 chronic obstructive pulmonary disease (COPD) [abstract]. Thorax. 2013;68(Suppl 3):A17(S28).
- Bonnevie T, Gravier FE, Debeaumont D, Viacroze C, Muir JF, Cuvelier A, et al. Home-based neuromuscular electrical stimulation as an add-on to pulmonary rehabilitation does not provide further benefits in patients with chronic obstructive pulmonary disease: a multicenter randomized trial. Arch Phys Med Rehabil. 2018 Aug;99(8):1462-70.
- Bourjeily G, Palermo F, Rochester C, Mohsenin V. Transcutaneous electrical stimulation of the lower extremities improves muscle mass, strength and exercise endurance in severe chronic obstructive pulmonary disease (COPD). Am J Resp Crit Care Med. 2001;163(5 Suppl):A21.
- Bourjeily-Habr G, Rochester CL, Palermo F, Snyder P, Mohsenin V. Randomised controlled trial of transcutaneous electrical muscle stimulation of the lower extremities in patients with chronic obstructive pulmonary disease. Thorax. 2002;57(12):1045-9.
- Dang DN, Gluck M, Pirnay F, Louis R, Vanderthommen M. Interest of neuromuscular electro-stimulation (NMES) in COPD patients during an ambulatory comprehensive respiratory rehabilitation program [abstract]. Eur Resp J. 2011;38(55):P4807.
- Gatewood CT, Tran AA, Dragoo JL. The efficacy of post-operative devices following knee arthroscopic surgery: a systematic review. Knee Surg Sports Traumatol Arthrosc. 2017;25(2):501-16.
- Guyatt GH, Berman LB, Townsend M, Pugsley SO, Chambers LW. A measure of quality of life for clinical trials in chronic lung disease. Thorax. 1987;42(10):773-8.
- Herzig D, Maffiuletti NA, Eser P. The application of neuromuscular electrical stimulation training in various non-neurologic patient populations: a narrative review. PM R. 2015;7(11):1167-78.
- Hill K, Cavalheri V, Mathur S, Roig M, Janaudis-Ferreira T, Robles P, et al. Neuromuscular electrostimulation for adults with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2018;5:CD010821.
- Holland AE, Spruit MA, Singh SJ. How to carry out a field walking test in chronic respiratory disease. Breathe (Sheff). 2015;11(2):128-39.Jones PW. St. George’s Respiratory Questionnaire: MCID. COPD. 2005;2(1):75-9.
- Kucio C, Niesporek J, Kucio E, Narloch D, Wegrzyn B. Evaluation of the effects of neuromuscular electrical stimulation of the lower limbs combined with pulmonary rehabilitation on exercise tolerance in patients with chronic obstructive pulmonary disease. J Hum Kinet. 2016;54:75-82.
- Latimer L, Greening N, Morgan M, Singh S, Bradding P, Steiner M. Unilateral neuromuscular electrical stimulation (NMES) of the quadriceps muscles in stable COPD. Eur Resp J. 2013;42:P3571.
- Lieber RL, Kelly MJ. Factors influencing quadriceps femoris muscle torque using transcutaneous neuromuscular electrical stimulation. Phys Ther. 1991;71(10):715-721; discussion 722-723.
- Lopez Lopez L, Granados Santiago M, Donaire Galindo M, Torres Sanchez I, Ortiz Rubio A, et al. Efficacy of combined electrostimulation in patients with acute exacerbation of COPD: randomised clinical trial. Med Clin (Barc). 2018. pii: S0025-7753(18)30212-4.
- Maddocks M, Nolan CM, Man WD, Polkey MI, Hart N, Gao W, et al. Neuromuscular electrical stimulation to improve exercise capacity in patients with severe COPD: a randomised double-blind, placebo-controlled trial. Lancet Respir Med. 2016;4:27-36.
- Maffiuletti NA, Gondin J, Place N, Stevens-Lapsley J, Vivodtzev I, Minetto MA. Clinical use of neuromuscular electrical stimulation for neuromuscular rehabilitation: what are we overlooking? Arch Phys Med Rehabil. 2018;99(4):806-12.
- Neder JA, Sword D, Cochrane LK, Mackay E, Ward SA, Clark CJ. A new rehabilitative strategy for severely-disabled patients with advanced COPD: neuromuscular electrical stimulation. Am J Resp Critical Care Med. 2001;163(5 Suppl):A967.
- Neder JA, Sword D, Ward SA, Mackay E, Cochrane LM, Clark CJ. Home based neuromuscular electrical stimulation as a new rehabilitative strategy for severely disabled patients with chronic obstructive pulmonary disease (COPD). Thorax 2002;57(4):333-7.
- Neves L, Vieira P, Chiappa A, Cipriano G, Umpierre D, Arena R, et al. Neuromuscular electrical stimulation improves clinical and physiological function in COPD patients (Abstract). Eur Respir J. 2014;44:P1289.
- Roy AL, Dupuis J, Viacroze C, Debeaumont D, Quieffin J, Marques MH, et al. Effects of neuromuscular electrical stimulation in addition to a rehabilitation program in patients with chronic obstructive pulmonary disease (Abstract). Ann Phys Rehab Med. 2013;56:e327.
- Tardif C, Roy AL, Viacroze C, Debeaumont D, Quieffin J, Marques MH, et al. Does neuromuscular electrical stimulation of the quadriceps during rehabilitation in COPD outpatients adds a benefit? Eur Respir J. 2015;46:OA1755.
- Tasdemir F, Inal-Ince D, Ergun P, Kaymaz D, Demir N, Demirci E, et al. Effects of exercise training and neuromuscular electrical stimulation on symptoms, muscle strength, exercise capacity, activities of daily living, and quality of life in COPD [abstract]. Eur Respir J. 2012;40:P2835.
- Tasdemir F, Inal-Ince D, Ergun P, Kaymaz D, Demir N, Demirci E, et al. Neuromuscular electrical stimulation as an adjunct to endurance and resistance training during pulmonary rehabilitation in stable chronic obstructive pulmonary disease. Expert Rev Respir Med. 2015;9:493-502.
- Vieira PJ, Chiappa AM, Cipriano G Jr, Umpierre D, Arena R, Chiappa GR. Neuromuscular electrical stimulation improves clinical and physiological function in COPD patients. Respir Med. 2014;108(4):609-20.
- Vivodtzev I, Debigare R, Dube A, Pare M-E, Gagnon P, Mainguy V. Molecular mechanisms of muscle hypertrophy after neuromuscular electrical stimulation in patients with severe COPD [abstract]. Am J Respir Critical Care Med. 2010;181:A3762.
- Vivodtzev I, Debigare R, Gagnon P, Mainguy V, Saey D, Dube A, et al. Functional and muscular effects of neuromuscular electrical stimulation in patients with severe COPD: a randomized clinical trial. Chest. 2012;141(3):716-25.
- Vivodtzev I, Gagnon P, Mainguy V, Belanger M, Maltais F. Mechanisms of improvement in exercise tolerance after neuromuscular electrical stimulation training in patients with severe COPD (Abstract). European Respiratory Society 19th Annual Congress; 2009 Sept 12-15; Vienna. 2009.
- Vivodtzev I, Lacasse Y, Maltais F. Neuromuscular electrical stimulation of the lower limbs in patients with chronic obstructive pulmonary disease. J Cardiopulm Rehabil Prev. 2008;28(2):79-91.
- Vivodtzev I, Pepin J-L, Vottero G, Mayer V, Porsin B, Levy P, et al. Improvement in quadriceps strength and dyspnea in daily tasks after 1 month of electrical stimulation in severely deconditioned and malnourished COPD. Chest 2006;129 (6):1540-8.
- Zanotti E, Felicetti G, Maini M, Fracchia C. Peripheral muscle strength training in bed-bound patients with COPD receiving mechanical ventilation: effect of electrical stimulation. Chest. 2003;124(1):292-6.
