Oncologie
C.4 Vermoeidheid
Aanbevelingen
Bied de beweeginterventie gesuperviseerd aan bij patiënten met kankergerelateerde vermoeidheid.
Breng in de anamnese factoren in kaart die invloed hebben op vermoeidheid (waaronder verwerkingsproblemen, angst voor een recidief, disfunctionele cognities, onregelmatig slaap-waakritme, over- of onderactiviteit, en irreële verwachtingen van de omgeving).
Overweeg een multidisciplinaire behandeling of cognitief-gedragsmatige aanpak in de volgende situaties:
- De patiënt ervaart op het moment van de kankerdiagnose al ernstige vermoeidheid.
- De patiënt ervaart angst/spanning, depressie of slaapproblemen.
- Na een beweeginterventie van 12 weken treedt geen vooruitgang op, ondanks een adequate fysiologische prikkel.
Overleg, als dit op basis van de genoemde situaties geïndiceerd lijkt, met de behandelend arts over verwijzing voor cognitieve gedragstherapie en over voortzetting van de beweeginterventie.
Gebruik de Multidimensionele Vermoeidheids Index (MVI -20) om kankergerelateerde vermoeidheid in kaart te brengen en te evalueren wanneer hier vanuit de anamnese aanleiding toe is.
Bepaal op basis van het ingangsniveau en de gestelde doelen de duur van een beweeginterventie, maar overweeg een beweeginterventie ten minste 12 weken aan te bieden met een frequentie van drie dagen per week, waarbij ten minste matig-intensief getraind wordt.
Bied de beweeginterventie gepersonaliseerd aan. Houd hierbij rekening met symptomen en beperkingen die de patiënt ervaart. Besteed behalve aan de FITT-factoren (frequentie, intensiteit, type en tijd) en trainingsprogressie tijdens de beweeginterventie, ook aandacht aan de algehele activiteitenregulatie.
Overweeg ‘High Intensity Interval Training’ (HIIT) bij patiënten die hieraan de voorkeur geven en die over voldoende bewegingsvaardigheden beschikken. Start bij patiënten bij wie HIIT niet uitgevoerd kan worden in verband met belemmerende comorbiditeit, te lage uitgangsfitheid of andere symptomen en beperkingen, met een beweeginterventie van continue intensiteit.
Aanleiding
Vermoeidheid is een van de meest voorkomende klachten bij mensen die leven met of na kanker. Vermoeidheidsklachten komen voor bij 75 tot 100% van de patiënten en kunnen langdurig aanhouden na afloop van een (succesvolle) behandeling (Abrahams 2016; Bower 2014; Hofman 2007). Door de negatieve impact van vermoeidheid op werkhervatting, dagelijkse activiteiten en sociale contacten heeft vermoeidheid een belangrijke invloed op de kwaliteit van leven van mensen die leven met of na kanker. Het is daarom belangrijk om deze vermoeidheidsklachten te verminderen.
Vermoeidheid kan niet alleen een rol spelen bij hulpvragen op het gebied van het bewegend functioneren, maar het verminderen van vermoeidheid kan ook een hulpvraag op zichzelf zijn. Voor de therapeut is het in beide gevallen van belang om te weten welke vormen van beweeginterventies het meest aannemelijk effectief zijn voor het reduceren (of beperken) van vermoeidheidsklachten.
Uitgangsvraag
Wat is de best passende beweeginterventie om aan kanker gerelateerde vermoeidheidsklachten te verminderen?
Literatuur
Er is sterk bewijs dat beweeginterventies effectief zijn om vermoeidheidsklachten te verminderen bij mensen die leven met of na kanker. Deze effecten zijn niet afhankelijk van demografische of klinische karakteristieken van de patiënt. De ernst van vermoeidheidsklachten voorafgaand aan een beweeginterventie vormt hierop een uitzondering; deze lijkt wel van invloed te zijn. Zowel tijdens als na de behandeling zijn de effecten groter bij patiënten met ernstige vermoeidheidsklachten voorafgaand aan een beweeginterventie in vergelijking met patiënten die weinig vermoeidheidsklachten ervaren.
Er is geen verschil gevonden in effectiviteit tussen interventies die tijdens of na de behandeling van kanker zijn aangeboden, tussen interventies met een verschillende frequentie (range: 2-5 sessies per week) en sessieduur (range: 15-120 minuten per sessie) of tussen aerobe training en krachttraining. Een dosis-effectrelatie wat betreft de intensiteit van de interventie is niet aangetoond. Een gesuperviseerde beweeginterventie onder begeleiding van een therapeut is effectiever dan een niet-gesuperviseerde beweeginterventie. Bij een gesuperviseerde beweeginterventie van 12 weken kan een positief effect op vermoeidheid verwacht worden. Er is geen verschil in effectiviteit aangetoond op vermoeidheidsklachten tussen een matig-intensieve aerobe beweeginterventie en ‘High Intensity Interval Training’ (HIIT). Bij vermoeidheidsklachten die worden veroorzaakt door angst en depressie, pijn, anemie, slaapproblemen, medicatie en ondervoeding heeft een beweeginterventie mogelijk geen positieve effecten op de vermoeidheid.
Overwegingen
In de ACSM-beweegrichtlijn voor mensen met kanker wordt beschreven dat een beweeginterventie van minimaal 12 weken, op 3 dagen per week van matige intensiteit, significant gunstige effecten heeft op vermoeidheid zowel tijdens als na de behandeling van kanker. Er is suggestief bewijs dat beweegvoorschriften van langer dan 30 minuten per sessie gedurende langer dan 12 weken resulteren in een grotere afname van vermoeidheid dan beweeginterventies van kortere duur (Campbell 2019). Dit betekent voor de dagelijkse klinische praktijk dat het niet aan te raden is om een beweeginterventie in te zetten op een lage intensiteit voor de vermindering van de vermoeidheid. Daarnaast hebben verschillende studies aangetoond dat de uitvoering van HIIT veilig is voor patiënten met kankergerelateerde vermoeidheid (Piraux 2020). De effectiviteit van HIIT in relatie tot andere vormen van training is onvoldoende beschreven. Regelmatige evaluatie van de interventie is gewenst in het kader van het evenwicht tussen de belasting en de belastbaarheid van de patiënt.
Bij vermoeidheidsklachten die worden veroorzaakt door angst en depressie, pijn, anemie, slaapproblemen, medicatie en ondervoeding heeft een beweeginterventie mogelijk geen positieve effecten op de vermoeidheid. Het is daarom belangrijk om in de anamnese de factoren die vermoeidheid in stand houden (waaronder verwerkingsproblemen, angst voor een recidief, disfunctionele cognities, onregelmatig slaap-waakritme, over- of onderactiviteit en irreële verwachtingen van de omgeving) in kaart te brengen (Blijenberg 2007). Wanneer een van deze factoren aanwezig is, is een gedragsmatige aanpak (bijvoorbeeld cognitieve gedragstherapie, psychologische en/of psychosomatische begeleiding), slaaptherapie, medicatie of een consult bij een diëtist mogelijk beter geschikt ter vermindering van de vermoeidheidsklachten (NCCN 2018; Portenoy 1999). Een gecombineerde begeleiding van een beweeginterventie en een gedragsmatige aanpak en/of de inzet van diëtetiek is te overwegen. Wanneer patiënten bij de diagnose al kampen met ernstige vermoeidheid is vooral een cognitief-gedragsmatige aanpak effectief (VRA 2018). De richtlijn ‘Medisch Specialistische Revalidatie’ kan geraadpleegd worden wanneer er sprake is van samenhangende problematiek waarbij meerdere zorgverleners een rol spelen.
De therapeut kan met behulp van psycho-educatie uitleggen dat vermoeidheid een logisch gevolg kan zijn van de ziekte en de behandeling ervan. Daarnaast kan de therapeut ondersteuning bieden bij de invulling van de dagelijkse activiteiten. Hierbij kan ook overwogen worden de patiënt te verwijzen naar een ergotherapeut. Het inzichtelijk maken van beweging die al aanwezig is in de dagindeling kan helpend zijn. Hierbij kan aan de patiënt duidelijk gemaakt worden dat fysieke activiteit niet alleen in de therapeutische omgeving plaatsvindt, maar ook in het dagelijks leven. Adviezen omtrent het invoeren van beweegactiviteiten in de ADL zijn gewenst. Sommige activiteiten of taken kunnen mogelijk op een andere manier ingevuld worden om fysieke activiteit te stimuleren. In deze adviezen is maatwerk essentieel voor het opstellen van realistische behandeldoelen en het geven van de optimale begeleiding. Sociale ondersteuning kan van toegevoegde waarde zijn. De therapeut kan de thuissituatie en sociale ondersteuning inventariseren. De sociale omgeving kan helpen in het creëren van routine, door bijvoorbeeld kinderen wandelend naar school te brengen of door een terugkerende wandel- of fietsafspraak te maken met een vriend of familielid. Bij de sturing of advisering is het belangrijk om aan te sluiten bij de voorkeuren en interesses van de patiënt.
Daarnaast is het essentieel om de problematiek te bekijken in het brede perspectief. Vermoeidheid is vrijwel nooit een op zichzelf staand probleem. Patiënten melden zich vaak met gecombineerde problematiek. Het is om die reden wenselijk een multidimensionale benadering en gecombineerde begeleiding toe te passen.
Ten aanzien van vermoeidheid in de palliatieve fase, zie de richtlijn ‘Vermoeidheid bij kanker in de palliatieve fase’ van de IKNL.
Zoekactie
Door de projectgroep is besloten deze vraag te beantwoorden aan de hand van bestaande richtlijnen en bevindingen die zijn gerapporteerd in recent gepubliceerd systematisch literatuuronderzoek. Dit literatuuronderzoek is uitgevoerd met de volgende vraagstelling: Wat is bij mensen die leven met of na kanker (P) die een beweeginterventie krijgen (I), in vergelijking met mensen die geen beweeginterventie krijgen (C), het verschil in vermoeidheid (O)? Hierbij is gekeken naar:
- De effecten van gesuperviseerde beweeginterventies op vermoeidheid zowel tijdens als na de behandeling van kanker in vergelijking met geen beweeginterventie.
- De effecten van niet-gesuperviseerde beweeginterventies op vermoeidheid zowel tijdens als na de behandeling van kanker in vergelijking met geen beweeginterventie.
- Verschil in effect tussen beweeginterventies bij verschillende patiëntkarakteristieken en trainingsvoorschriften (frequentie, intensiteit, type en tijdsduur; FITT).
- Het effect van ‘High Intensity Interval Training’ (HIIT) in vergelijking met een beweeginterventie van continue intensiteit op vermoeidheid bij mensen die leven met of na kanker.
Voor de eerste drie aspecten zijn reeds gepubliceerde systematische meta-analyses geïncludeerd (Buffart 2017, 2018; Van Vulpen 2020). Deze onderzoeken hadden als doel de individuele deelnemersgegevens van gerandomiseerde interventiestudies te gebruiken om moderatoren van de interventie-effecten op vermoeidheid, kwaliteit van leven en fysiek functioneren te onderzoeken.
Voor het vierde aspect is in het kader van deze richtlijn een systematisch literatuuronderzoek uitgevoerd naar de effectiviteit van HIIT op vermoeidheid in vergelijking met een beweeginterventie van continue intensiteit bij mensen die leven met of na kanker. Op 12 februari 2021 is met relevante zoektermen een systematische zoekactie uitgevoerd naar gerandomiseerde gecontroleerde studies (RCT’s), systematische reviews en meta-analyses in onder meer de databases MEDLINE, Embase, Cochrane en PEDro. De verantwoording van de zoekactie is opgenomen in bijlage C.4-1.
In de volgende tabel staan de selectiecriteria van deze zoekactie.
Karakteristieken van de geïncludeerde studies
Op basis van een systematisch literatuuronderzoek van Buffart (2017) in PubMed, Embase, PsycINFO en CINAHL bleken 69 gerandomiseerde studies naar beweeginterventie geschikt voor inclusie. Ten behoeve van deze richtlijn zijn de originele data van 36 van deze studies opgenomen in een database. Van de overige studies was het niet mogelijk om de originele data te verzamelen. Er is geen verschil in effect gevonden tussen de studies die wel en niet geïncludeerd zijn.
In de meta-analyse van Van Vulpen (2020) werden 36 individuele studies geïncludeerd. In vijf studies werd geen vermoeidheid gerapporteerd. De gegevens uit de overige 31 studies zijn gebruikt om de effecten van een beweeginterventie op vermoeidheid te onderzoeken. In die 31 studies werden in totaal 2437 patiënten met verschillende typen kanker gerandomiseerd naar een beweeginterventie en 1929 deelnemers naar de controlegroep. Van deze patiënten was een groot deel vrouw (78%). 70% was gediagnosticeerd met borstkanker; de gemiddelde leeftijd was 54 jaar. Onderzocht werd of demografische en klinische eigenschappen en veel of weinig vermoeidheid voorafgaand aan de beweeginterventie invloed hadden op het effect van de beweeginterventie, en ook werd het effect van de verschillende trainingsvoorschriften onderzocht.
In de meta-analyse van Buffart (2018) zijn dezelfde studies geïncludeerd als in de meta-analyse van Van Vulpen (2020).
1. Effectiviteit van gesuperviseerde beweeginterventies op vermoeidheid
De resultaten van de studie van Van Vulpen (2020) laten zien dat een gesuperviseerde beweeginterventie tijdens en na de behandeling van kanker kan leiden tot minder vermoeidheid (z-score β= -0,23 (95%-BI -0,29 tot -0,17). De effecten zijn onderzocht met een mixed effect model en er is gecorrigeerd voor de beginwaarden. Een random intercept op studieniveau is toegepast en de verschillen tussen de groepen zijn gerapporteerd in z-scores (interpretatie: 0,2-0,5 = klein effect; 0,5-0,8 = matig effect; ≥ 0,8 = groot effect).
2. Effectiviteit van niet-gesuperviseerde beweeginterventies op vermoeidheid
Uit de meta-analyse van Van Vulpen (2020) blijkt dat niet-gesuperviseerde beweeginterventies resulteren in een zeer klein en niet-significant effect (z-score β= -0,04; 95%-BI -0,13 tot 0,04).
3. Verschil in effect tussen beweeginterventies bij verschillende patiëntkarakteristieken en trainingsvoorschriften
Patiëntkarakteristieken
In een studie waarin dezelfde gegevens zijn gebruikt als in de studie van Van Vulpen is onderzocht of er verschillen bestaan in de effectiviteit van beweeginterventies op vermoeidheid tussen patiënten die voorafgaand aan de interventie meer of minder vermoeidheid ervaren (Buffart 2018). Dit is onderzocht door de patiënten in subgroepen te verdelen op basis van de ervaren vermoeidheid voorafgaand aan de interventie. De resultaten van deze analyses laten een significant effect zien van de vermoeidheid voorafgaand aan de interventie (z-score β= -0,05; 95%-BI -0,10-0,00) met grotere effecten voor patiënten die voorafgaand aan de interventie meer dan gemiddelde vermoeidheid ervaren (z-score β= -0,22; 95%-BI -0,37 tot -0,07) in vergelijking met weinig vermoeide patiënten (z-score β= -0,03; 95%-BI -0,13 tot 0,08). Zie de volgende figuur.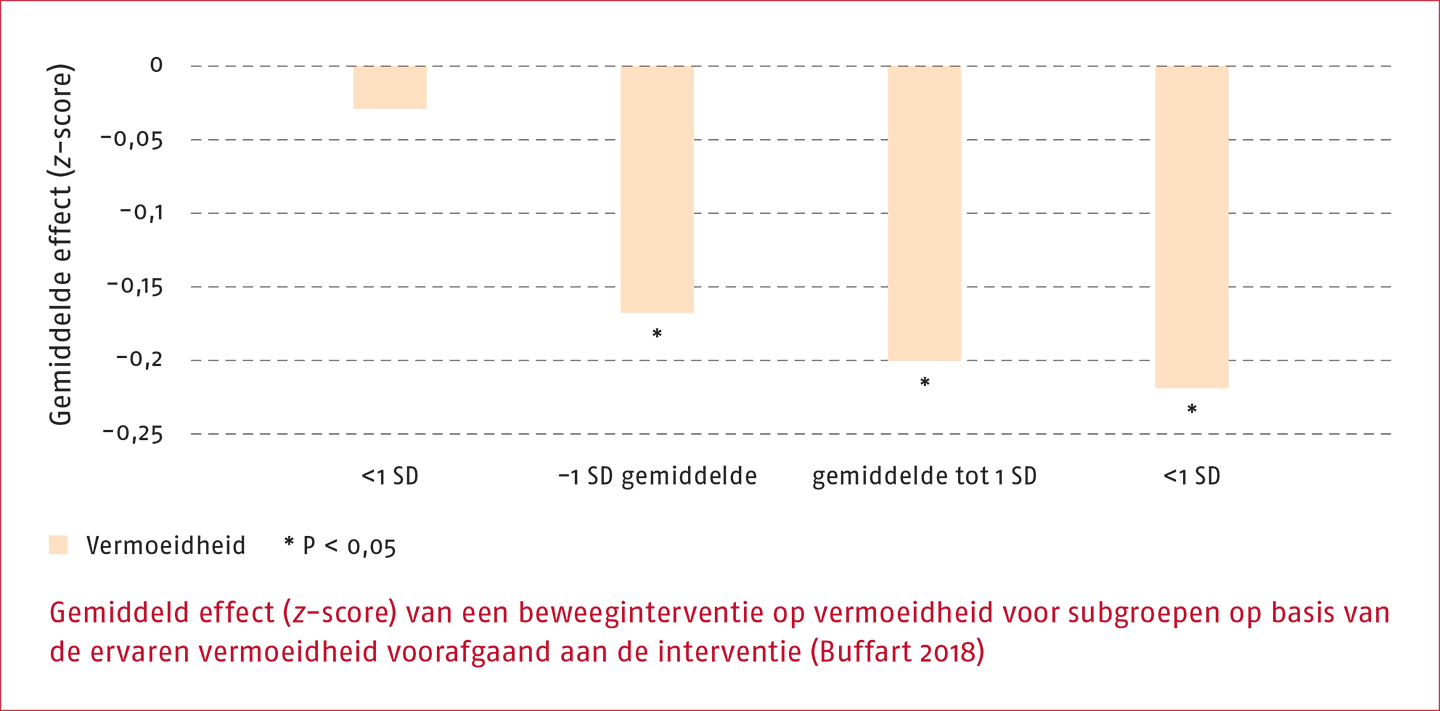
Een gemiddelde vermoeidheidsscore correspondeerde in deze studie met een waarde van 12,1 voor algemene vermoeidheid gemeten met de Multidimensionele Vermoeidheids Index en een waarde van 37,1 gemeten met de ‘Functional Assessment of Chronic Illness Therapy’ (FACIT) vermoeidheidsschaal.
Voor zowel gesuperviseerde als niet-gesuperviseerde interventies werd door Van Vulpen (2020) geen verschil in effect gevonden tussen groepen op basis van leeftijd, geslacht, opleidingsniveau, burgerlijke staat, body mass index (BMI), type kanker of soort behandeling.
Trainingsvoorschriften
In de meta-analyse van Van Vulpen (2020) werd op basis van individuele patiëntgegevens geen aanwijzing gevonden voor verschillen in effecten op vermoeidheid tussen gesuperviseerde interventies die verschilden in frequentie, sessieduur, intensiteit of type. In dit onderzoek werden wel aanwijzingen gevonden dat interventies van 12 weken of korter grotere effecten lieten zien in vergelijking met interventies langer dan 12 weken, met name als de interventie langer dan 24 weken duurde (≤ 12 weken: z-score β = -0,29, 95%-BI -0,39 tot -0,20; > 12-24 weken: z-score β = -0,25, 95%-BI -0,41 tot -0,10; > 24 weken: z-score β = -0,11, 95%-BI -0,22 tot 0,00). De auteurs van de review schrijven dit toe aan afnemende therapietrouw en/of toenemende contaminatie vanaf 12 weken, hoewel ook een mogelijk plafondeffect niet wordt uitgesloten. Deze bevinding staat in contrast met de bevindingen die in de ACSM-richtlijnen worden beschreven, waarin een groter effect werd gevonden bij programma’s die langer dan 12 weken duurden en die een langere sessieduur hadden.
4. Effectiviteit van HIIT in vergelijking met beweeginterventies van continue intensiteit
De zoekactie in het kader van deze richtlijn leverde 185 hits op. Op basis van titel en abstract zijn 124 studies geëxcludeerd. Er bleven 61 studies over, waarvan 23 systematische literatuuronderzoeken die alle op volledige tekst zijn beoordeeld, waarop uiteindelijk één systematisch literatuuronderzoek werd geïncludeerd omdat daarin de effectiviteit van HIIT was vergeleken met training van continue intensiteit en geen training (Mugele 2019). In dit systematisch literatuuronderzoek is slechts één studie geïncludeerd waarin het effect op vermoeidheid van HIIT is vergeleken met een beweeginterventie van continue intensiteit (Schmitt 2016). Deze kleine studie werd uitgevoerd bij 28 vrouwen met een gemiddelde leeftijd van 53 jaar die voor verschillende vormen van kanker waren behandeld. De interventie bestond uit zes sessies van 75 minuten op een laag-tot-matig intensieve continue intensiteit of acht HIIT-sessies in een periode van drie weken. Vermoeidheid werd gemeten voorafgaand aan en na afloop van de interventie met behulp van de Multidimensionele Vermoeidheids Index (MVI) (hoe hoger de score hoe groter de vermoeidheid). Zowel HIIT (-1,31 ± 2,02 punten) als laag-tot-matig-intensieve training (-3,23 ± 2,52 punten) resulteerde gemiddeld in een vermindering van de algemene vermoeidheid. Laag-tot-matig-intensieve training resulteerde in een grotere vermindering van de algemene vermoeidheid in vergelijking met HIIT (p = 0,04), maar dit verschil werd niet gevonden voor de andere subschalen van vermoeidheid, gemeten met de MVI (fysieke vermoeidheid, mentale vermoeidheid, verminderde motivatie en verminderde activiteit).
30 studies betroffen gerandomiseerde studies. Eén betrof een studie die werd gepubliceerd na het systematisch literatuuronderzoek van Mugele (2019) en relevant bleek voor de beantwoording van de uitgangsvraag (Piraux 2020). In deze studie werden de effecten van HIIT vergeleken met respectievelijk krachttraining en geen training bij patiënten met prostaatkanker tijdens de behandeling met radiotherapie. In totaal werden 78 patiënten geïncludeerd, van wie er 27 werden gerandomiseerd naar de HIIT-trainingsgroep, 25 naar de groep die krachttraining kreeg en 26 naar de controlegroep. Vermoeidheid werd gemeten met de ‘Functional Assessment of Chronic Illness Therapie - Fatigue’ (FACIT-F) (hoe lager de score hoe groter de vermoeidheid). De resultaten laten zien dat zowel HIIT (p = 0,012) als krachttraining (p = 0,039) een toename in vermoeidheid kan beperken in vergelijking met de controlegroep. Er werden geen verschillen gevonden tussen de effecten van krachttraining en HIIT (effectgrootte niet gerapporteerd).
De overige acht studies waren geen systematische reviews of RCT’s. Daarmee voldeden deze studies niet aan de inclusiecriteria en ze zijn daarom niet meegenomen in de verdere analyse.
Individuele studiekwaliteit (RoB)
De opzet en uitvoering van de individuele studies (‘risk of bias’; RoB) zijn beoordeeld met behulp van de risk-of-bias (RoB) tool van de Cochrane Collaboration in het systematisch literatuuronderzoek van Van Vulpen (2020) (gerapporteerd in Buffart, 2017). Ook voor de beoordeling van de studies van Schmitt (2016) en Piraux (2020) is gebruikgemaakt van de Cochrane RoB-tool. Zie voor de beoordeling van de RoB van de individuele studies bijlage C.4-2.
Kwaliteit van de gevonden literatuur
Ten aanzien van de eerste drie aspecten is ondanks de afwezigheid van blindering bij vrijwel alle studies, ervoor gekozen niet af te waarderen voor studieopzet en -kwaliteit, aangezien blindering in dergelijke studies onmogelijk is en overige aspecten binnen de RoB-tool zeer goed gescoord werden.
Op basis van de ‘trim-and-fill’-procedure die is uitgevoerd door Van Vulpen (2020) en Buffart (2018) is er reden om aan te nemen dat er sprake is van publicatiebias. De kwaliteit van bewijs voor de effecten van een gesuperviseerde beweeginterventie op vermoeidheid is op grond dáárvan wel afgewaardeerd en als redelijk beoordeeld. De variatie in de effecten en het betrouwbaarheidsinterval van studies die een niet-gesuperviseerde beweeginterventie vergeleken met geen beweeginterventie is groot. De kwaliteit van het bewijs is daarom afgewaardeerd op basis van inconsistentie en publicatiebias, waarmee de kwaliteit van het bewijs voor de effecten van niet-gesuperviseerde interventies op vermoeidheid laag is.
Het bewijs voor verschillen in effecten tussen beweeginterventies die variëren in FITT-factoren is afkomstig uit de studie van Van Vulpen (2020). De kwaliteit van het bewijs is redelijk, omdat ook voor deze vergelijking afgewaardeerd is voor publicatiebias.
Ten aanzien van het vierde aspect is voor individuele studiekwaliteit afgewaardeerd doordat de randomisatieprocedures onduidelijk waren beschreven. Daarnaast is afgewaardeerd voor inconsistentie omdat de effectgrootte onduidelijk was gerapporteerd. Voor de vergelijking tussen studies waarin HIIT werd vergeleken met een beweeginterventie van continue intensiteit kon de publicatiebias niet beoordeeld worden. De kwaliteit van het bewijs komt uit op laag.
Het GRADE-evidenceprofiel van de gevonden studies is opgenomen in de volgende tabel.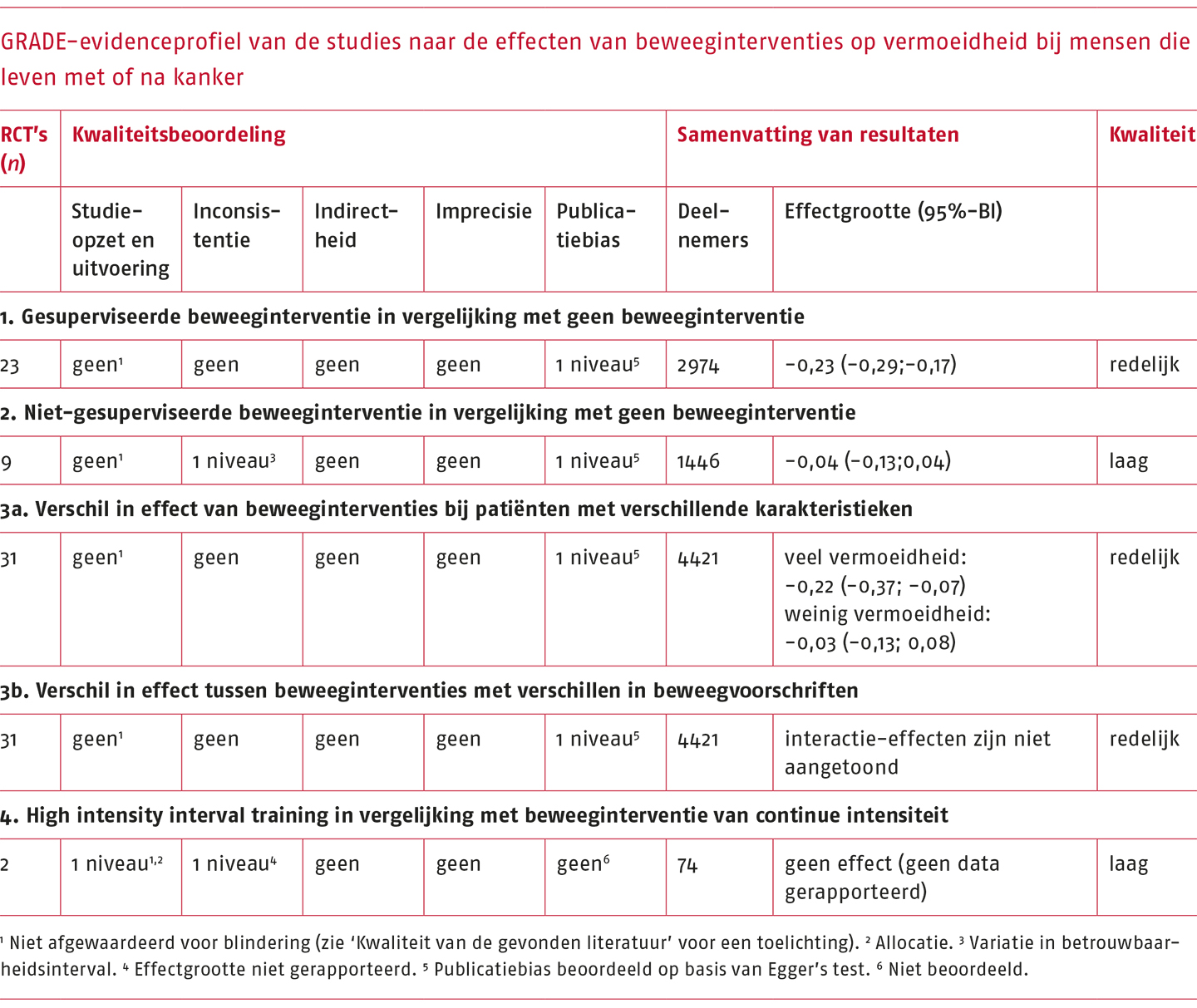
Conclusies op basis van de literatuur
Er is een klein effect van gesuperviseerde beweeginterventies in vergelijking met geen beweeginterventies op de uitkomstmaat vermoeidheid. De kwaliteit van bewijs is redelijk.
Er is geen effect van een niet-gesuperviseerde beweeginterventie in vergelijking met geen beweeginterventie op de uitkomstmaat vermoeidheid. De kwaliteit van bewijs is laag.
Er is een groter effect van beweeginterventies bij patiënten met meer dan gemiddelde vermoeidheid in vergelijking met patiënten met minder dan gemiddelde vermoeidheid. Er is geen verschil in effect aangetoond tussen interventies van laag-tot-matige intensiteit en matig-tot-hoge intensiteit, tussen een interventie van < 3 sessies per week en ≥ 3 sessies per week, en tussen krachttraining of aerobe training. De kwaliteit van bewijs is redelijk.
Er is geen verschil in effect op vermoeidheid tussen beweeginterventies waarbij HIIT wordt toegepast, in vergelijking met beweeginterventies waarbij training van continue intensiteit wordt toegepast. De kwaliteit van bewijs is laag.
Overwegingen
De aanbevelingen worden niet alleen bepaald door bevindingen in de literatuur. Ook andere overwegingen spelen daarbij een rol.
De overwegingen betroffen:
Gewenste effecten: Vanuit de literatuur zijn kleine positieve effecten gerapporteerd van een beweeginterventie op vermoeidheid. De effectiviteit van gesuperviseerde beweeginterventies is groter dan die van niet-gesuperviseerde beweeginterventies. Er zijn geen aantoonbare verschillen tussen de effecten op vermoeidheid van beweeginterventies van continue intensiteit en HIIT. De werkgroep merkt op dat behalve effecten op ervaren vermoeidheid, beweeginterventies ook bijdragen aan een betere algehele fitheid, een beter cardiovasculair risicoprofiel en een hogere kwaliteit van leven. Daarbij is het tevens van belang dat fitheid een positieve rol speelt tijdens de behandeling en gunstige effecten heeft op de uitkomsten van de behandeling. Er zijn bij de overweging voor een beweeginterventie daarom mogelijk meer gezondheidsuitkomsten betrokken dan alleen vermoeidheid.
Ongewenste effecten: Er zijn geen ongewenste effecten van beweeginterventies gerapporteerd in de geïdentificeerde studies.
Kwaliteit gewenste effecten: De bewijskracht voor de effecten op vermoeidheid van een gesuperviseerde beweeginterventie is redelijk. De kwaliteit van bewijs heeft betrekking op het bewijs van sterk gestandaardiseerde beweeginterventies. In de oefen- en fysiotherapeutische praktijk zal een hogere mate van aanpassing op het individu aan de orde zijn, waarbij behalve fysiologische effecten van beweeginterventies ook cognitief-gedragsmatige componenten worden toegepast (zoals ‘goal setting’, psycho-educatie, coaching op activiteitenregulatie) en mogelijk substitutie naar of toevoeging van functionele trainingsvormen die zijn gericht op voor de patiënt waardevolle dagelijkse activiteiten.
Balans tussen gewenste en ongewenste effecten: Aangezien er geen ongewenste effecten gerapporteerd zijn, overtreffen de gewenste effecten van de interventie de ongewenste effecten.
Waarde aan gewenste effecten: De effecten van beweeginterventies op vermoeidheid zijn klein en het is onwaarschijnlijk dat met die effecten de grens voor klinische relevantie overschreden wordt. In wetenschappelijk onderzoek wordt echter vaak een selectie van actieve deelnemers geïncludeerd en wordt gerapporteerd dat de controlegroep vaak ook erg actief is. Het effect van een beweeginterventie op vermoeidheidsklachten is in de praktijk mogelijk groter dan wordt gerapporteerd in wetenschappelijk onderzoek.
Variatie in waarde aan gewenste effecten: Er is een significant moderatie-effect gerapporteerd van de vermoeidheid voorafgaand aan de interventie (z-score β= -0,05; 95%-BI -0,10 tot 0,00) met grotere effecten voor deelnemers die voorafgaand aan de interventie meer dan gemiddelde vermoeidheid ervaren (z-score β= -0,22; 95%-BI -0,37 tot -0,07) in vergelijking met deelnemers met weinig vermoeidheid (z-score β= -0,03; 95%-BI -0,13 tot 0,08).
Benodigde middelen (kosten): Er zijn geen extra kosten verbonden aan de interventie.
Variatie in benodigde middelen (kosten): Omdat in de oefen- en fysiotherapiepraktijk geen standaardprogramma’s worden aangeboden, maar zorg op maat, kan er sprake zijn van variatie in kosten. Een ‘graded-activity’-programma bij patiënten met bewegingsangst heeft waarschijnlijk meer tijd nodig om tot de gewenste resultaten te komen dan een trainingsprogramma dat meteen op voldoende intensiteit kan worden aangeboden. Ook de aanwezigheid van risico’s op grond van (zeer) lage belastbaarheid, comorbiditeit of lage bewegingsvaardigheid, kan leiden tot een langer dan gemiddelde behandelduur.
Kosteneffectiviteit: Informatie over de kosteneffectiviteit is beperkt. Ongesuperviseerde beweeginterventies tijdens de behandeling met chemotherapie zijn waarschijnlijk niet kosteneffectief vanuit maatschappelijk perspectief. Beweeginterventies tijdens chemotherapie onder begeleiding van een fysio- of oefentherapeut zijn dat mogelijk wel, afhankelijk van de ‘willingness to pay’ en de gangbare inschatting van de ziektelast (Van Waart 2017). De kosten vanuit het perspectief van de gezondheidszorg zijn beperkt en zeer laag in vergelijking met de totale kosten van de gezondheidszorg voor mensen met kanker (VRA 2018).
Aanvaardbaarheid: Beweeginterventies zijn aanvaardbaar voor therapeuten en mensen tijdens of na de behandeling van kanker. De voor deze richtlijn geraadpleegde ervaringsdeskundigen gaven hierbij wel aan dat zij prijs stellen op een bredere advisering dan alleen trainingsbegeleiding op locatie bij de fysio- of oefentherapeut. Met name het verkrijgen van inzicht in (het vinden van de juiste balans tussen) belasting en belastbaarheid in activiteiten van het dagelijks leven werd hierbij expliciet benoemd.
Haalbaarheid: Beweeginterventies tijdens of na de behandeling van kanker worden al veelvuldig toegepast en worden als haalbaar beschouwd.
Conclusie
De werkgroep besluit therapie aan te bevelen bij mensen die leven met of na kanker en vermoeidheid. Indien de patiënt op het moment van de kankerdiagnose al ernstige vermoeidheid, angst/spanning, depressie of slaapproblemen ervaart of wanneer na een beweeginterventie van 12 weken geen vooruitgang is geboekt, ondanks een adequate fysiologische prikkel, dient een multidisciplinaire behandeling of cognitief-gedragsmatige aanpak overwogen te worden.
Meetinstrumenten
Alle meetinstrumenten die opgenomen zijn in de ‘KNGF-standaard Beweeginterventie Oncologie’ en in de richtlijn ‘Medisch specialistische revalidatie bij oncologie’ van de Nederlandse Vereniging van Revalidatieartsen (VRA 2018) zijn in de overwegingen betrokken.
De Lastmeter kan gebruikt worden als signaleringsinstrument van last in het algemeen en onderliggende oorzaken van die last, zoals vermoeidheid. Het is belangrijk om bij de diagnostiek een multidimensionele benadering toe te passen en te kijken naar de fysieke, emotionele en cognitieve dimensies van vermoeidheid.
Voor het diagnosticeren van vermoeidheid wordt de Multidimensionele Vermoeidheids Index (MVI) aanbevolen. Voor de beoordeling van onderliggende oorzaken van vermoeidheid is mogelijk aanvullend onderzoek nodig. Denk hierbij aan bloedonderzoek of een vragenlijst over angst en depressie (‘Hospital Anxiety and Depression Scale’ (HADS)). Hiervoor is onderlinge afstemming met betrokken primaire oncologische behandelaars of de huisarts belangrijk.
Het diagnosticeren van angst of depressiestoornissen valt buiten het expertisegebied van de fysio- en oefentherapeut. Het is wel aan te bevelen om op deze stemmingsproblemen te screenen. Bij een score boven de daarvoor geldende afkappunten kan met de patiënt besproken worden of verdere diagnostiek en/of behandeling door een daarvoor gekwalificeerde zorgverlener wenselijk is.
Bij de selectie van meetinstrumenten is gewerkt volgens het stappenplan van het ‘Raamwerk Klinimetrie’ (KNGF 2016). Het stappenplan bestaat uit acht stappen. Per stap wordt de keuze voor de meetinstrumenten verantwoord en vervolgens wordt onderscheid gemaakt tussen de aanbevolen en optionele meetinstrumenten.
Stap 1: Wat wil je meten?
Vermoeidheid is een parameter binnen het ICF-domein ‘functies en anatomische eigenschappen’ die tijdens de anamnese kan worden geobjectiveerd ten behoeve van het stellen van doelen, het monitoren van de interventie en ten behoeve van de (eind)evaluatie tijdens het diagnostisch en therapeutisch proces.
Voor de differentiaaldiagnostiek kan een aanvullend meetinstrument worden gebruikt.
Stap 2: Waarom wil je meten?
De genoemde parameter kan met zowel een diagnostisch doel als een evaluatief doel gemeten worden.
Stap 3: Met welk soort meetinstrument wil je meten?
Er is gezocht naar een meetinstrument dat geschikt is voor het objectiveren van de parameter vermoeidheid. Voor vermoeidheid is de Multidimensionele Vermoeidheids Index (MVI) geanalyseerd, omdat deze aanbevolen wordt in de richtlijn ‘Medisch specialistische revalidatie bij oncologie (2.0)’ (VRA 2018).
Stap 4: Hoe vind je een meetinstrument?
Het meetinstrument is beschikbaar via www.meetinstrumentenzorg.nl.
Stap 5: Wat is de hanteerbaarheid?
De MVI is een zelfrapportage-instrument en bestaat uit 20 stellingen en uitspraken die betrekking hebben op vijf dimensies van vermoeidheid en de consequenties hiervan. De MVI is goed hanteerbaar en wordt het meest gebruikt in de klinische zorg in Nederland voor het meten van kankergerelateerde vermoeidheid (VRA 2018). Het invullen van de stellingen kost ongeveer 5 minuten.
Stap 6: Wat is de klinimetrische kwaliteit?
De MVI is betrouwbaar, valide en gevoelig voor verandering (Meek 2000; Minton 2009). De interne consistentie van de subschalen is onderzocht bij Nederlandse patiënten met kanker die radiotherapie ondergingen en beoordeeld als goed tot zeer goed (Cronbachs α = 0,79 tot 0,93; Smets 1996). In dezelfde studie is ondersteunend bewijs gevonden voor voldoende constructvaliditeit en structurele validiteit. In een grote studie in de algemene bevolking bleef de structurele validiteit niet overeind en bleek de subschaal ‘Algemene vermoeidheid’ de betrouwbaarste maat voor vermoeidheid (Kieffer 2021). Een ander recent onderzoek waarin een grote studie was opgenomen met 1818 patiënten met kanker, vond ook geen bewijs voor de onderliggende factor ‘structuur’, maar adviseert niettemin de subschalen wel zoals bedoeld te scoren (Hinz 2020).
Stap 7 en 8: Zijn er normwaarden beschikbaar en hoe bereken en interpreteer je de gegevens?
Hoe hoger de score op de MVI, des te groter het niveau van vermoeidheid en hoe meer de vermoeidheid een beperkende factor is. De scoringstool van het Integraal Kankercentrum Nederland (IKNL) kan gebruikt worden om de score te berekenen.
Voor het evalueren van de vermoeidheid van een individuele patiënt in de loop van de tijd kunnen de schaalscores gebruikt worden. Voor het vergelijken met een referentiegroep van (Duitse) mensen na kanker kunnen de z-scores gebruikt worden. Met behulp van deze tool kan per dimensie de afwijking van de score van de patiënt ten opzichte van de referentiegroep berekend worden. Omdat getwijfeld wordt aan de validiteit van de indeling in subschalen, beveelt de werkgroep aan om deze scores te gebruiken als gesprekshulp en niet als definitief diagnosticum. De z-scores zijn opgenomen als bijlage C.4-3.
Het evidence-to-decisionformulier voor beweeginterventies bij vermoeidheid is opgenomen als bijlage C.4-4.
- Abrahams HJ, Gielissen MF, Schmits IC, Verhagen CAHHVM, Rovers MM, Knoop H. Risk factors, prevalence, and course of severe fatigue after breast cancer treatment: a meta-analysis involving 12 327 breast cancer survivors. Ann Oncol. 2016;27(6):965-74.
- Adams SC, DeLorey DS, Davenport MH, Fairey AS, North S, Courneya KS. Effects of high-intensity interval training on fatigue and quality of life in testicular cancer survivors. Br J Cancer. 2018; 118(10):1313-21.
- Berger AM, Abernethy AP, Atkinson A, Barsevick AM, Breitbart WS, Cella D, Cimprich B, Cleeland C, Eisenberger MA, Escalante CP, Jacobsen PB, Kaldor P, Ligibel JA, Murphy BA, O’Connor T, Pirl WF, Rodler E, Rugo HS, Thomas J, Wagner LI. Cancer-related fatigue. Clinical practice guidelines in oncology. J Natl Compr Canc Netw. 2010. 8(8):904-31.
- Bleijenberg G, Gielissen MFM, Voskamp H. Cognitieve gedragstherapie bij vermoeidheid na kanker. Ned Tijdschr Oncol. 2007. 4(5):200-5.
- Bower JE. Cancer-related fatigue-mechanisms, risk factors, and treatments. Nat Rev Clin Oncol, 2014;11(10):597-609.
- Buffart LM, Kalter J, Sweegers MG, Courneya KS, Newton RU, Aaronson NK, Jacobsen PB, May AM, Galvão DA, Chinapaw MJ, Steindorf K, Irwin ML, Stuiver MM, Hayes S, Griffith KA, Lucia A, Mesters I, van Weert E, Knoop H, Goedendorp MM, Mutrie N, Daley AJ, McConnachie A, Bohus M, Thorsen L, Schulz KH, Short CE, James EL, Plotnikoff RC, Arbane G, Schmidt ME, Potthoff K, van Beurden M, Oldenburg HS, Sonke GS, van Harten WH, Garrod R, Schmitz KH, Winters-Stone KM, Velthuis MJ, Taaffe DR, van Mechelen W, Kersten MJ, Nollet F, Wenzel J, Wiskemann J, Verdonck-de Leeuw IM, Brug J. Effects and moderators of exercise on quality of life and physical function in patients with cancer: An individual patient data meta-analysis of 34 RCTs. Cancer Treat Rev. 2017 Jan;52:91-104.
- Buffart LM, Sweegers MG, May AM, Chinapaw MJ, van Vulpen JK, Newton RU, Galvao DA, Aaronson NK, Stuiver MM, Jacobsen PB, Verdonck-de Leeuw IM, Steindorf K, Irwin ML, Hayes S, Griffith KA, Lucia A, Herrero-Roman F, Mesters I, van Weert E, Knoop H, Goedendorp MM, Mutrie N, Daley AJ, McConnachie A, Bohus M, Thorsen L, Schulz KH, Short CE, James EL, Plotnikoff RC, Arbane G, Schmidt ME, Potthoff K, van Beurden M, Oldenburg HS, Sonke GS, van Harten WH, Garrod R, Schmitz KH, Winters-Stone KM, Velthuis MJ, Taaffe DR, van Mechelen W, Jose Kersten M, Nollet F, Wenzel J, Wiskemann J, Brug J, Courneya KS. Targeting exercise interventions to patients with cancer in need: an individual patient data meta-analysis. J Natl Cancer Inst. 2018;110(11):1190-200.
- Campbell KL, Winters-Stone KM, Wiskemann J, May AM, Schwartz AL, Courneya KS, Zucker DS, Matthews CE, Ligibel JA, Gerber LH, Morris GS, Patel AV, Hue TF, Perna FM, Schmitz KH. Exercise guidelines for cancer survivors: consensus statement from international multidisciplinary roundtable. Med Sci Sports Exerc. 2019;51(11):2375-90.
- Hinz A, Benzing C, Brähler E, Zenger M, Herzberg PY, Finck C, Schmalbach B, Petrowski K. Psychometric properties of the Multidimensional Fatigue Inventory (MFI-20), derived from seven samples. J Pain Sympt Man. 2020;59(3):717-23.
- Hofman M, Ryan JL, Figueroa-Moseley CD, Jean-Pierre P, Morrow GR. Cancer-related fatigue: the scale of the problem. Oncologist. 2007;12:4-10.
- Integraal Kankercentrum Nederland (IKNL). Richtlijn vermoeidheid bij kanker in de palliatieve fase. Utrecht: IKNL; 2019. Geraadpleegd op 1 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Kieffer JM, Starreveld DEJ, Boekhout A, Bleiker EMA. A questionable factor structure of the multidimensional fatigue inventory in the general Dutch population. J Clin Epidemiol. 2021;14;137:266-76.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)/Zuyd Onderzoek. Toepassing van het ‘Raamwerk klinimetrie voor evidence based products’ om meetinstrumenten te ordenen in de KNGF-richtlijnen. Amersfoort/Heerlen: KNGF/Zuyd; 2016.
- Meek PM, Nail LM, Barsevick A, Schwartz AL, Stephen S, Whitmer K, Beck SL, Jones LS, Walker BL. Psychometric testing of fatigue instruments for use with cancer patients. Nurs Res. 2000;49(4):181-90.
- Minton O, Stone P. A systematic review of the scales used for the measurement of cancer-related fatigue (CRF). Ann Oncol. 2009. 20(1):17-25.
- Mugele H, Freitag N, Wilhelmi J, Yang Y, Cheng S, Bloch W, Schumann M. High-intensity interval training in the therapy and aftercare of cancer patients: a systematic review with meta- analysis. J Cancer Surviv. 2019;13(2):205-23.
- National Comprehensive Cancer Network (NCCN). Survivorship, Version 2.2018, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2018 Oct;16(10):1216-47.
- Nederlandse Vereniging voor Revalidatieartsen (VRA). Richtlijn medisch specialistische revalidatie bij oncologie (2.0). Utrecht: VRA; 2018. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Piraux E, Caty G, Renard L, Vancraeynest D, Tombal B, Geets X, Reychler G. Effects of high-intensity interval training compared with resistance training in prostate cancer patients undergoing radiotherapy: a randomized controlled trial. Prostate Cancer Prostatic Dis. 2020. 2021 Mar;24(1):156-65.
- Integraal Kankercentrum Nederland (IKNL). Richtlijn Vermoeidheid bij kanker in de palliatieve fase. Utrecht: IKNL; 2019. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Portenoy RK, Itri LM. Cancer-related fatigue: guidelines for evaluation and management. Oncologist, 1999. 4(1):1-10.
- Schmitt J, Lindner N, Reuss-Borst M, Holmberg HC, Sperlich B. A 3-week multimodal intervention involving high-intensity interval training in female cancer survivors: a randomized controlled trial. Physiol Rep. 2016;4(3):e12693.
- Schulz SVW, Laszlo R, Otto S, Prokopchuk D, Schumann U, Ebner F, Huober J, Steinacker JM. Feasibility and effects of a combined adjuvant high-intensity interval/strength training in breast cancer patietns: a single-center pilot study. Disabil Rehabil. 2018;40(13):1501-8.
- Smets EMA, Garssen B, Cull A, de Haes JCJM. Application of the multidimensional fatigue inventory (MFI-20) in cancer patients receiving radiotherapy. Br J Cancer. 1996;73(2):241-5.
- Stuiver MM, Wittink HM, Velthuis MJ, Kool N, Jongert WAM. KNGF-standaard beweeginterventie Oncologie. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF); 2011.
- van Vulpen JK, Sweegers MG, Peeters PHM, Courneya KS, Newton RU, Aaronson NK, Jacobsen PB, Galvao DA, Chinapaw MJ, Steindorf K, Irwin ML, Stuiver MM, Hayes S, Griffith KA, Mesters I, Knoop H, Goedendorp MM, Mutrie N, Daley AJ, McConnachie A, Bohus M, Thorsen L, Schulz KH, Short CE, James EL, Plotnikoff RC, Schmidt ME, Ulrich CM, van Beurden M, Oldenburg HS, Sonke GS, van Harten WH, Schmitz KH, Winters-Stone KM, Velthuis MJ, Taaffe DR, van Mechelen W, Kersten MJ, Nollet F, Wenzel J, Wiskemann J, Verdonck-de Leeuw IM, Brug J, May AM, Buffart LM. Moderators of exercise effects on cancer-related ratigue: a meta-analysis of individual patient data. Med Sci Sports Exerc. 2020;52(2):303-4.
- van Waart H, Van Dongen JM, Van Harten WH, Stuiver MM, Huijsmans R, Hellendoorn-van Vreeswijk JAJH, Sonke GS, Aaronson NK. Cost-utility and cost-effectiveness of physical exercise during adjuvant chemotherapy. Eur J Health Econ. 2018;19(6):893-904.
